题目内容
16.下列有关化学基本概念的判断依据正确的是( )| A. | 弱电解质:溶液的导电能力弱 | B. | 共价化合物:含有共价键 | ||
| C. | 离子化合物:含有离子键 | D. | 金属晶体:能够导电 |
分析 A.电解质强弱划分依据:是否完全电离;
B.依据共价化合物概念解答;
C.依据离子化合物概念解答;
D.金属晶体为由金属阳离子与自由电子通过金属键结合而成的晶体.
解答 解:A.弱电解质是只能部分电离的电解质,电解质强弱与电解质溶液的导电能力强弱无关,故A错误;
B.共价化合物为只含有共价键的化合物,故B错误;
C.离子化合物为含有离子键的化合物,故C正确;
D.金属晶体为由金属阳离子与自由电子通过金属键结合而成的晶体,金属晶体含有自由电子,一定导电,但是导电的不一定是金属晶体,如石墨、合金等,故D错误;
故选:C.
点评 本题考查了化学中的基本概念,熟悉电解质强弱划分依据、共价化合物、离子化合物定义、金属晶体的概念是解题关键,题目难度不大.

练习册系列答案
相关题目
13.25℃时,已知0.5mol/L的HA溶液pH=3,现向10mL的HA溶液中滴加一定体积的amol•L-1的NaOH溶液,下列有关说法中错误的是( )
| A. | 25℃时HA溶液的电力平衡常数约为2×10-6 | |
| B. | 当滴入10mLNaOH时溶液恰好为中性,则a<0.5mol•L-1 | |
| C. | 滴加过程中,溶液中的离子浓度有可能为c(Na+)=c(A-) | |
| D. | 滴加过程中,溶液中的离子浓度关系不可能有c(A-)>c(H+)>c(Na+)>c(OH-) |
7.向27.2g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2.在所得溶液中加入1.0molL-1的NaOH溶液1.0L,此时溶液呈中性,金属铜离子已完全沉淀,沉淀质量为39.2g.下列有关说法不正确的是( )
| A. | Cu与Cu2O的物质的量之比为2:1 | |
| B. | 沉淀为氢氧化铜 | |
| C. | 产生的NO在标准状况下的体积为4.48 L | |
| D. | Cu、Cu2O与硝酸恰好完全反应 |
4.下列叙述正确的是( )
| A. | 石墨烯是一种比钢铁更强韧的新型材料 | |
| B. | 大量使用化肥和农药,以提高农作物产量 | |
| C. | 道尔顿提出了原子论、门捷列夫提出了分子论 | |
| D. | 无论是风力发电还是潮汐发电,都是将化学能转化为电能 |
1.氮化钠和氢化钙都是离子化合物,与水反应的化学方程式(末配平)如下:Na3N+H2O→NaOH+NH3,CaH2+H2O→Ca(OH)2+H2.有关它们的叙述正确的是( )
| A. | 离子半径的大小:Na+>N3->H- | |
| B. | 它们与水发生的反应均属于氧化还原反应 | |
| C. | 两种化合物均只含离子键,不含共价键 | |
| D. | 两固体混合物溶于足量盐酸中可得到三种盐 |
6.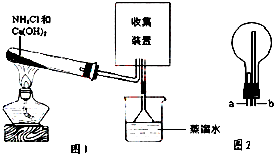 某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )
某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )
 某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )
某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )| A. | 图1试管中发生反应的化学方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O | |
| B. | 向图1烧杯中滴加酚酞溶液,观察到溶液变红,说明氨水呈碱性 | |
| C. | 用图2装置收集氨气时,进气口是a | |
| D. | 图1中的三角漏斗能起到防止氨气倒吸的作用 |
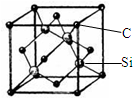 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: