题目内容
11.稀硝酸和足量的铜反应的化学方程式如下:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O(1)该反应的氧化剂是HNO3,氧化产物是Cu(NO3)2.
(2)若在标准状况下生成11.2LNO气体,则在反应中被还原的HNO3的物质的量为0.5mol.
分析 在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,Cu为还原剂,N元素的化合价由+5降低为+2价,转移的电子为6e-,HNO3为氧化剂,结合元素化合价的变化解答该题.
解答 解:(1)N元素的化合价降低,Cu元素的化合价升高,则硝酸为氧化剂,硝酸铜为氧化产物,
故答案为:HNO3,Cu(NO3)2;
(2)根据化学方程式,当生成2molNO时,转移的电子为6mol,消耗硝酸8mol,在8mol硝酸中,只有2mol硝酸被还原,因n(NO)=$\frac{11.2L}{22.4L/mol}$=0.5mol,则在反应中被还原的HNO3的物质的量为0.5mol,故答案为:0.5mol.
点评 本题考查氧化还原反应,为高频考点,侧重学生的分析、计算能力的考查,明确元素的化合价变化及原子守恒的方法来分析是解答本题的关键,并注意反应中化学计量数与转移电子数目的关系来解答即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.氮化钠和氢化钙都是离子化合物,与水反应的化学方程式(末配平)如下:Na3N+H2O→NaOH+NH3,CaH2+H2O→Ca(OH)2+H2.有关它们的叙述正确的是( )
| A. | 离子半径的大小:Na+>N3->H- | |
| B. | 它们与水发生的反应均属于氧化还原反应 | |
| C. | 两种化合物均只含离子键,不含共价键 | |
| D. | 两固体混合物溶于足量盐酸中可得到三种盐 |
2.将a g镁铝合金投入到x mL 1mol/L的盐酸中,金属完全溶解,再加入y mL 2mol/L NaOH溶液,沉淀达到最大值,质量为(a+3.4)g,则下列说法不正确的是( )
| A. | 镁铝合金与盐酸反应转移电子数为0.2NA | |
| B. | x=2y | |
| C. | 沉淀为Mg(OH)2和Al(OH)3的混合物 | |
| D. | a的取值范围为0.9<a<1.2 |
19.下列关于浓硫酸和浓硝酸的叙述正确的是( )
| A. | 浓硫酸和浓硝酸均具有强氧化性 | |
| B. | 浓硫酸和浓硝酸长期露置在空气中浓度均会增大 | |
| C. | 常温下浓硫酸和浓硝酸均不能用铝制容器贮存 | |
| D. | 浓硫酸和浓硝酸常温下均可以与Cu迅速反应 |
6.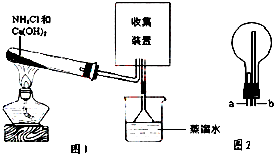 某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )
某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )
 某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )
某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )| A. | 图1试管中发生反应的化学方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O | |
| B. | 向图1烧杯中滴加酚酞溶液,观察到溶液变红,说明氨水呈碱性 | |
| C. | 用图2装置收集氨气时,进气口是a | |
| D. | 图1中的三角漏斗能起到防止氨气倒吸的作用 |
16.下列叙述不正确的是( )
| A. | Na、Mg、Al元素最高化合价依次升高 | B. | P、S、Cl原子半径依次减小 | ||
| C. | N、O、F元素非金属性依次减弱 | D. | Li、Na、K原子的电子层数依次增多 |
3.下列物质存放方法错误的是( )
| A. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| B. | 漂白粉长期放置在烧杯中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 少量的钠保存在煤油中 |
20.下列描述及热化学方程式均正确的是( )
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热233kJ•mol-1 |