题目内容
12.483g Na2SO4•10H2O中所含的Na+的物质的量是3mol,SO42-的物质的量是1.5mol,所含O原子的数目是21NA个.分析 根据n=$\frac{m}{M}$结合晶体的组成、构成来进行计算.
解答 解:483g Na2SO4•10H2O的物质的量为:n=$\frac{m}{M}$=$\frac{483g}{322g/mol}$=1.5mol,
根据晶体的组成可知,
n(Na+)=2n(Na2SO4•10H2O)=2×1.5mol=3mol,
n(SO42-)=n(Na2SO4•10H2O)=1.5mol,
n(O)=14n(Na2SO4•10H2O)=14×1.5mol=21mol,
N(O)=nNA=21NA,
故答案为:3mol;1.5mol;21NA.
点评 本题考查物质的量的相关计算,题目难度不大,注意有关物质的量的计算公式的运用,把握有关概念.

练习册系列答案
相关题目
2.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 焰火的五彩缤纷是某些金属元素化学性质的表现 | |
| B. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| C. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆的原理相似 | |
| D. | 明矾作为净水剂,可以除去废水中的铜离子 |
20.22gNaHCO3和NaOH的混合物在密闭容器中加热到500℃使其充分反应后排出气体,然后冷却至常温,称得其质量变为20.2g,则下列说法正确的是( )
| A. | 反应后剩余固体为碳酸钠 | B. | 排出气体为CO2和水蒸气 | ||
| C. | NaOH的质量为13.6g | D. | NaHCO3的质量为18g |
7.下列有关叙述正确的是( )
| A. | 金属元素的原子只有还原性,其阳离子只有氧化性 | |
| B. | O2与O3互为同位素,相互转化为化学变化 | |
| C. | 1H 2H 3H互为同位素,其性质相似 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
17.下列化学用语正确的是( )
| A. | 次氯酸分子的电子式 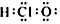 | B. | CH4Si的结构式 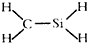 | ||
| C. | HCN分子的结构式:H-C≡N | D. | 丙烷分子的比例模型 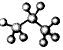 |
1.化学键使得一百多种元素构成了世界的万事万物.关于化学键的下列叙述中正确的是( )
| A. | 碘易升华是因为分子间的共价键较弱 | |
| B. | 构成单质分子的微粒一定含有化学键 | |
| C. | 离子化合物可能含共价键,共价化合物中可能含离子键 | |
| D. | 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 |
11.下列仪器都不能用酒精灯直接加热的是( )
①烧杯 ②坩埚 ③蒸发皿 ④试管 ⑤蒸馏烧瓶 ⑥锥形瓶 ⑦燃烧匙.
①烧杯 ②坩埚 ③蒸发皿 ④试管 ⑤蒸馏烧瓶 ⑥锥形瓶 ⑦燃烧匙.
| A. | ③⑥⑦ | B. | ①⑤⑥ | C. | ②③⑤ | D. | ④⑤⑥⑦ |