题目内容
1.化学键使得一百多种元素构成了世界的万事万物.关于化学键的下列叙述中正确的是( )| A. | 碘易升华是因为分子间的共价键较弱 | |
| B. | 构成单质分子的微粒一定含有化学键 | |
| C. | 离子化合物可能含共价键,共价化合物中可能含离子键 | |
| D. | 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 |
分析 A.升华属于物理变化与分子间作用力有关;
B.稀有气体中不存在任何化学键;
C.共价化合物中只含有共价键;
D.离子化合物中的静电作用既有吸引也有排斥.
解答 解:A.升华属于物理变化与分子间作用力有关,与共价键的强弱无关,故A错误;
B.稀有气体分子属于单原子分子,分子中不存在任何化学键,故B错误;
C.共价化合物中只含有共价键,离子化合物中一定含有离子键,可能含共价键,故C错误;
D、离子化合物中的静电作用既有吸引也有排斥,则在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用,故D正确;
故选D.
点评 本题考查化学键和分子间作用力对物质的性质的影响,明确氢键、范德华力、化学键的不同及对物质的性质的影响即可解答,难度不大.

练习册系列答案
相关题目
9.下列指定反应的离子方程式书写正确的是( )
| A. | 电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3+OH- | |
| D. | 向KAl(SO4)2溶液中加过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
16.下列分子的核磁共振氢谱中只有一个峰值的是( )
| A. | CH3CH2CH3 | B. | CH3COOH | C. | CH3COOCH3 | D. | CH3OCH3 |
6.已知A(g)+B(g)?C(g)+D(g) 反应的平衡常数和温度的关系如表:
完成下列填空:
(1)该反应的平衡常数表达式K=$\frac{c(C)c(D)}{c(A)c(B)}$,该反应为放热反应(选填“吸热”、“放热”).当反应达到平衡时,升高温度,A的转化率减小(选填“增大”、“减小”或“不变”).
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol/(L•s),则6s时c(A)=0.022mol/L,C的物质的量为0.09mol.
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molA(g)和3molB(g),判断该反应达到平衡状态的依据是d.
a.c(A)=c(C) b.容器中压强不变
c.混合气体的平均相对分子质量不变 d.v逆(D)=v正(B)
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K=$\frac{c(C)c(D)}{c(A)c(B)}$,该反应为放热反应(选填“吸热”、“放热”).当反应达到平衡时,升高温度,A的转化率减小(选填“增大”、“减小”或“不变”).
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol/(L•s),则6s时c(A)=0.022mol/L,C的物质的量为0.09mol.
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molA(g)和3molB(g),判断该反应达到平衡状态的依据是d.
a.c(A)=c(C) b.容器中压强不变
c.混合气体的平均相对分子质量不变 d.v逆(D)=v正(B)
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.
13.硫酸铵是化工、染织、医药、皮革等工业原料.某硫酸工厂利用副产品Y处理尾气SO2得到CaSO4,再与相邻的合成氨工厂联合制备(NH4)2SO4,工艺流程如图:
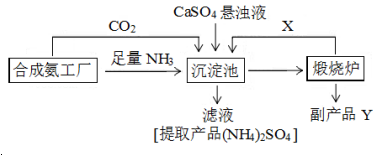
请回答以下问题:
(1)下列有关(NH4)2SO4溶液的说法正确的是
A.电离方程式:(NH4)2SO4?2NH4++SO42-
B.水解离子方程式:NH4++H2O?NH3•H2O+H+
C.离子浓度关系:c(NH4+)+c(H+)═c(SO42-)+c(OH-)
D.微粒浓度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3•H2O)>c(OH-)
(2)硫酸工业中,V2O5作催化剂时发生反应2SO2+O2?2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择表中最合适的温度和压强分别是420℃、1.01×105Pa.该反应420℃时的平衡常数>520℃时的平衡常数(填“>”、“<”或“=”).
(3)在2L密闭容器中模拟接触法制备三氧化硫时,若第12分钟恰好达到平衡,测得生成SO3的物质的量为1.2mol,计算前12分钟用氧气表示反应速率v(O2)为0.025mol/(L.min).
(4)副产品Y是氧化钙.沉淀池中发生的主要反应方程式是CaSO4+CO2+2NH3+H2O→CaCO3↓+(NH4)2SO4.
(5)从绿色化学和资源综合利用的角度说明上述流程的主要优点是产生的CO2循环使用,物质充分利用,副产品有用,无污染性物质产生.

请回答以下问题:
(1)下列有关(NH4)2SO4溶液的说法正确的是
A.电离方程式:(NH4)2SO4?2NH4++SO42-
B.水解离子方程式:NH4++H2O?NH3•H2O+H+
C.离子浓度关系:c(NH4+)+c(H+)═c(SO42-)+c(OH-)
D.微粒浓度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3•H2O)>c(OH-)
(2)硫酸工业中,V2O5作催化剂时发生反应2SO2+O2?2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择表中最合适的温度和压强分别是420℃、1.01×105Pa.该反应420℃时的平衡常数>520℃时的平衡常数(填“>”、“<”或“=”).
 | 1.01×105Pa | 5.05×105Pa | 1.01×106Pa |
| 420℃ | 0.9961 | 0.9972 | 0.9984 |
| 520℃ | 0.9675 | 0.9767 | 0.9852 |
| 620℃ | 0.8520 | 0.8897 | 0.9276 |
(4)副产品Y是氧化钙.沉淀池中发生的主要反应方程式是CaSO4+CO2+2NH3+H2O→CaCO3↓+(NH4)2SO4.
(5)从绿色化学和资源综合利用的角度说明上述流程的主要优点是产生的CO2循环使用,物质充分利用,副产品有用,无污染性物质产生.
10.向含amolBa(OH)2和amolNaOH的混合液中通入bmolCO2,下列说法不正确的是( )
| A. | 当a=b时,发生的离子总反应为:Ba2++2OH-+CO2═BaCO3↓+H2O | |
| B. | 当3a≤2b时发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=b时,发生的离子总反应为:Ba2++3OH-+2CO2═BaCO3↓+H2O+HCO3- | |
| D. | 2a<b<3a时,溶液中n(HCO3-)=(2b-3a)mol |
20.如图用石墨电极电解CuCl2溶液.下列分析正确的是( )
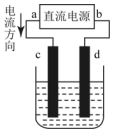

| A. | c极发生还原反应 | B. | 每生成6.4gCu,转移电子0.2mol | ||
| C. | 阳极反应式:Cu2++2e→Cu | D. | 在溶液中电子由d流向c |