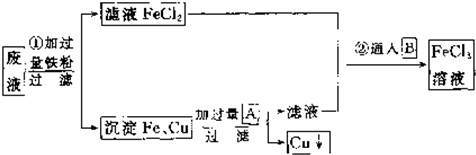
题目内容
用下列实验装置进行相应实验,能达到实验目的是-玻璃棒( )
A、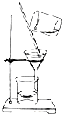 用如图所示装置除去Fe(OH)3胶体中含有的少量FeCl3杂质 |
B、 用如图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
C、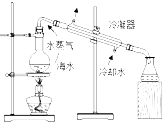 用如图所示装置从海水制取蒸馏水 |
D、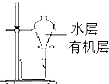 用如图所示装置分离酒精萃取碘水中的碘 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.溶液和胶体都能透过滤纸;
B.氯化铵受热易分解;
C.利用沸点差异蒸馏海水可得蒸馏水;
D.酒精与水不分层.
B.氯化铵受热易分解;
C.利用沸点差异蒸馏海水可得蒸馏水;
D.酒精与水不分层.
解答:
解:A.提纯胶体利用渗析法,而图1为过滤装置,溶液和胶体都能透过滤纸,不合理,故A错误;
B.氯化铵受热易分解,图2为蒸发装置,最终不能得到氯化铵,应利用冷却结晶法,故B错误;
C.利用沸点差异蒸馏海水可得蒸馏水,图中蒸馏装置合理,故C正确;
D.酒精与水不分层,应选苯或四氯化碳作萃取剂,然后利用图4装置分液,故D错误;
故选C.
B.氯化铵受热易分解,图2为蒸发装置,最终不能得到氯化铵,应利用冷却结晶法,故B错误;
C.利用沸点差异蒸馏海水可得蒸馏水,图中蒸馏装置合理,故C正确;
D.酒精与水不分层,应选苯或四氯化碳作萃取剂,然后利用图4装置分液,故D错误;
故选C.
点评:本题考查化学实验方案的评价,为高频考点,涉及混合物分离、提纯的考查,综合性较强,侧重分离原理、物质性质及实验装置的考查,注意选项A中胶体的性质为解答的易错点,题目难度不大.

练习册系列答案
相关题目
下面对日本福岛核电站泄漏的放射性碘-131(
I)、铯-137(
Cs)说法正确的是( )
131 53 |
137 55 |
| A、碘-131的中子数为78 |
| B、碘-131质量数为53 |
| C、碘与铯互称同位素 |
| D、铯-137的放射性是化学性质 |
已知常温下:KSP (AgCl)=1.8×10-10 mol2?L-2,KSP (Ag2CrO4)=1.9×10-12 mol3?L-3,下列叙述正确的是( )
| A、AgCl在饱和NaCl溶液中的 KSP比在纯水中的 KSP 小 |
| B、向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP (AgCl)<KSP (AgI) |
| C、将0.001 mol?L-1 的AgNO3溶液滴入0.001 mol?L-1 的KCl和0.001 mol?L-1 的K2CrO4 溶液中先产生Ag2CrO4沉淀 |
| D、向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
3.04g铜镁合金完全溶解于100mL密度为1.40g?mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体2240mL(标准状况),向反应后的溶液中加入2.00mol?L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀.下列说法不正确的是( )
| A、得到5.08g沉淀时,加入NaOH溶液的体积是600mL |
| B、该合金中铜与镁的物质的量之比是2:l |
| C、该浓硝酸中HNO3的物质的量浓度是14.0 mol?L-1 |
| D、NO2和N2O4的混合气体中,NO2的体积分数是80% |
 甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇 燃料电池的总反应式2CH40+302=2C02↑+4H20,如图是该燃料电池的示意图.下列说法错误的是( )
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇 燃料电池的总反应式2CH40+302=2C02↑+4H20,如图是该燃料电池的示意图.下列说法错误的是( )| A、燃料电池将化学能转化为电能 |
| B、a是甲醇,b是氧气 |
| C、质子从M电极区穿过交换膜移向N电极区 |
| D、负极反应:CH40-6e-+H20=C02↑+6H+ |
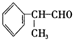 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下: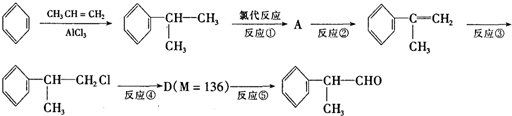
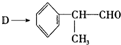 反应的化学方程式为
反应的化学方程式为