题目内容
3.04g铜镁合金完全溶解于100mL密度为1.40g?mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体2240mL(标准状况),向反应后的溶液中加入2.00mol?L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀.下列说法不正确的是( )
| A、得到5.08g沉淀时,加入NaOH溶液的体积是600mL |
| B、该合金中铜与镁的物质的量之比是2:l |
| C、该浓硝酸中HNO3的物质的量浓度是14.0 mol?L-1 |
| D、NO2和N2O4的混合气体中,NO2的体积分数是80% |
考点:有关混合物反应的计算
专题:计算题
分析:金属离子全部沉淀时,得到5.08g沉淀为氢氧化铜、氢氧化镁,则沉淀中氢氧根离子的质量为:5.08g-3.04g=2.04g,氢氧根离子的物质的量为
=0.12mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.12、64x+24y=3.04,解得:x=0.04,y=0.02;
密度为1.40g?mL-1、质量分数为63%的浓硝酸的物质的量浓度为:c=
=
mol/L=14.0mol/L,100mL该硝酸中含有硝酸的物质的量为:14.0mol/L×0.1L=1.4mol,
A.反应后溶质为硝酸钠,根据氮元素守恒计算硝酸钠的物质的量,根据钠离子守恒可知n(NaOH)=n(NaNO3),再根据V=
计算需要氢氧化钠溶液的体积;
B.根据以上分析计算出铜与镁的物质的量之比;
C.根据以上计算结果进行判断;
D.根据n=
计算NO2和N2O4混合气体的物质的量,设二氧化氮的物质的量为amol,根据电子转移列方程计算.
| 2.04g |
| 17g/mol |
密度为1.40g?mL-1、质量分数为63%的浓硝酸的物质的量浓度为:c=
| 1000ρω |
| M |
| 1000×1.40×63% |
| 63 |
A.反应后溶质为硝酸钠,根据氮元素守恒计算硝酸钠的物质的量,根据钠离子守恒可知n(NaOH)=n(NaNO3),再根据V=
| n |
| c |
B.根据以上分析计算出铜与镁的物质的量之比;
C.根据以上计算结果进行判断;
D.根据n=
| V |
| Vm |
解答:
解:金属离子全部沉淀时,得到5.08g沉淀为氢氧化铜、氢氧化镁,则沉淀中氢氧根离子的质量为:5.08g-3.04g=2.04g,氢氧根离子的物质的量为
=0.12mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.12、64x+24y=3.04,解得:x=0.04,y=0.02,故合金中Cu与Mg的物质的量之比是0.04mol:0.02mol=2:1,
密度为1.40g?mL-1、质量分数为63%的浓硝酸的物质的量浓度为:c=
=
mol/L=14.0mol/L,100mL该硝酸中含有硝酸的物质的量为:14.0mol/L×0.1L=1.4mol,
A.反应后溶质为硝酸钠,根据氮元素守恒可知,硝酸钠的物质的量为:1.4mol-0.08mol-0.02mol×2=1.28mol,故需要氢氧化钠溶液的体积为:
=0.64L=640mL,故A错误;
B.根据分析可知,合金中Cu与Mg的物质的量之比是0.04mol:0.02mol=2:1,故B正确;
C.密度为1.40g?mL-1、质量分数为63%的浓硝酸的物质的量浓度为:c=
=
mol/L=14.0mol/L,故C正确;
D.NO2和N2O4混合气体的物质的量为:
=0.1mol,设二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.1-a)mol,根据电子转移守恒可知,a×1+(0.1-a)×2×1=0.12,解得a=0.08,NO2的体积分数为:
×100%=80%,故D正确;
故选A.
| 2.04g |
| 17g/mol |
密度为1.40g?mL-1、质量分数为63%的浓硝酸的物质的量浓度为:c=
| 1000ρω |
| M |
| 1000×1.40×63% |
| 63 |
A.反应后溶质为硝酸钠,根据氮元素守恒可知,硝酸钠的物质的量为:1.4mol-0.08mol-0.02mol×2=1.28mol,故需要氢氧化钠溶液的体积为:
| 1.28mol |
| 2mol/L |
B.根据分析可知,合金中Cu与Mg的物质的量之比是0.04mol:0.02mol=2:1,故B正确;
C.密度为1.40g?mL-1、质量分数为63%的浓硝酸的物质的量浓度为:c=
| 1000ρω |
| M |
| 1000×1.40×63% |
| 63 |
D.NO2和N2O4混合气体的物质的量为:
| 2.24L |
| 22.4L/mol |
| 0.08mol |
| 0.1mol |
故选A.
点评:本题考查混合物的有关计算,难度中等,理解反应发生的过程为解答关键,是对学生综合能力的考查,注意根据守恒思想在化学计算中的应用方法.

练习册系列答案
相关题目
用下列实验装置进行相应实验,能达到实验目的是-玻璃棒( )
A、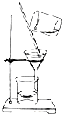 用如图所示装置除去Fe(OH)3胶体中含有的少量FeCl3杂质 |
B、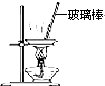 用如图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
C、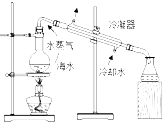 用如图所示装置从海水制取蒸馏水 |
D、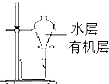 用如图所示装置分离酒精萃取碘水中的碘 |
一定温度下,满足下列条件的溶液一定呈酸性的是( )
| A、c(H+)>c(OH-)的任意水溶液 |
| B、加酚酞后显无色的溶液 |
| C、pH=6的某溶液 |
| D、能与金属Al反应放出H2的溶液 |
下列关于金属钠的叙述中正确的是( )
| A、钠可以保存在煤油或四氯化碳中 |
| B、钠长久露置在空气中最终生成NaHCO3 |
| C、钠在空气中燃烧,火焰黄色,生成淡黄色的Na2O2 |
| D、钠与水反应的实验现象可以说明钠硬度小、熔点低、密度小于水 |



 A和甲是自石油和煤的两种基本化工原料,A是气态烃,甲是液态烃.B和D是生活中两种常见的有机物,F是高分子化合物.相互转化关系如图所示(已知:R-CHO
A和甲是自石油和煤的两种基本化工原料,A是气态烃,甲是液态烃.B和D是生活中两种常见的有机物,F是高分子化合物.相互转化关系如图所示(已知:R-CHO