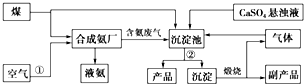
题目内容
1.下列有关化工生产的叙述中正确的是( )| A. | 将煤液化、气化,有利于提高燃料的燃烧效率,减少污染物的排放 | |
| B. | 侯氏制碱法,向饱和NaCl溶液中先通入CO2再通入氨气制取纯碱 | |
| C. | 电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等 | |
| D. | 工业生产硫酸时,建立高烟囱可以降低地面SO2的浓度,减少空气污染 |
分析 A.将煤液化、气化,能提高燃料的燃烧效率;
B.二氧化碳在水中的溶解度较小,不能形成碳酸氢钠的饱和溶液;
C.阴极和阳极的电子得失守恒,阳极是不纯的铜,含有其他金属或者非金属,阳极失去的电子由铜和其他金属承担;阴极析出较纯的铜单质,电子全部由较纯的铜提供;
D.二氧化硫是一种有毒的物质,能够污染空气,容易和水反应生成显酸性的物质,从而污染环境.
解答 解:A.液态和气态燃烧能够充分燃烧,则将煤液化、气化,能提高燃料的燃烧效率,减少有毒气体的排放,故A正确;
B.二氧化碳在水中的溶解度较小,不能形成碳酸氢钠的饱和溶液,所以应该先向饱和NaCl溶液中通入氨气再通入CO2,故B错误;
C.阴极和阳极的电子得失守恒,阳极是不纯的铜,含有其他金属或者非金属,阳极失去的电子由铜和其他金属承担;阴极析出较纯的铜单质,电子全部由较纯的铜提供;因此阳极溶解的铜肯定比阴极析出的纯铜质量少,故C错误;
D.增加烟筒的高度虽然可以使周围地表面SO2的含量减少,但是二氧化硫的排放总量不变,且污染范围扩大了,空气中的二氧化硫与雨水形成酸雨,形成污染,故D错误.
故选A.
点评 本题考查较综合,涉及工业制纯碱、电解原理的应用、煤的综合利用、二氧化硫的污染与防治等知识点,明确物质的性质是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.乙二醇是一种重要的工业防冻剂和合成高分子化合物的单体,实验室模拟生产乙二醇的过程:
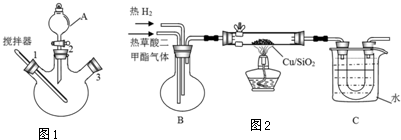
(一)草酸二甲酯的制备
实验室用图1所示装置模拟草酸二甲酯的制备:
步骤1:先往三颈烧瓶中加入甲醇,然后通过A在搅拌器工作时缓慢加入浓硫酸,混合液冷却后,再加入草酸;
步骤2:将A换为球形冷凝管,在3处塞上温度计,在一定的温度下回流2-3小时;
步骤3:将混合液冷凝分离得到草酸二甲酯.
(二)乙二醇的制取
实验室用图2所示的装置模拟工业乙二醇的制取(夹持设备和部分加热装置省略)
反应方程式为:
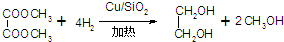
回答下列问题:
(1)仪器A的名称为分液漏斗,步骤3中首个操作是将混合物与冷水混合,则“混合”的正确操作是将混合物沿杯壁慢慢注入装有冷水的烧杯(或容器)中,并不断搅拌.
(2)装置B的作用是使草酸二甲酯和氢气混合均匀.烧杯C中水的温度不能低于55℃,原因是温度低于55℃,未反应的草酸二甲酯会凝结堵塞导管.
(3)对粗产品(主要含乙二醇、草酸二甲酯和甲醇)进行精制,蒸馏收集197.3℃(197℃左右即可)℃的馏分.
(4)实验过程中,使用了16g H2和59g草酸二甲酯,最后得到乙二醇为12.4g,乙二醇的产率为40%.
(5)设计实验证明乙二醇为二元醇:取62g乙二醇,加入足量金属钠充分反应,收集并测量生成的氢气的质量是2g(或其他合理答案,乙二醇与氢气的量符合正确比例即可).

| 物质 | 熔点 | 沸点 | 水溶性 | 相对分子质量 |
| 乙二醇 | -12.9℃ | 197.3℃ | 溶于水、醇 | 62 |
| 甲醇 | -97℃ | 64.7℃ | 与水互溶 | 32 |
| 草酸二甲酯 | 54℃ | 163.5℃ | 微熔于冷水,溶于醇和醚 | 118 |
实验室用图1所示装置模拟草酸二甲酯的制备:
步骤1:先往三颈烧瓶中加入甲醇,然后通过A在搅拌器工作时缓慢加入浓硫酸,混合液冷却后,再加入草酸;
步骤2:将A换为球形冷凝管,在3处塞上温度计,在一定的温度下回流2-3小时;
步骤3:将混合液冷凝分离得到草酸二甲酯.
(二)乙二醇的制取
实验室用图2所示的装置模拟工业乙二醇的制取(夹持设备和部分加热装置省略)
反应方程式为:
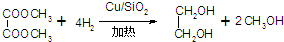
回答下列问题:
(1)仪器A的名称为分液漏斗,步骤3中首个操作是将混合物与冷水混合,则“混合”的正确操作是将混合物沿杯壁慢慢注入装有冷水的烧杯(或容器)中,并不断搅拌.
(2)装置B的作用是使草酸二甲酯和氢气混合均匀.烧杯C中水的温度不能低于55℃,原因是温度低于55℃,未反应的草酸二甲酯会凝结堵塞导管.
(3)对粗产品(主要含乙二醇、草酸二甲酯和甲醇)进行精制,蒸馏收集197.3℃(197℃左右即可)℃的馏分.
(4)实验过程中,使用了16g H2和59g草酸二甲酯,最后得到乙二醇为12.4g,乙二醇的产率为40%.
(5)设计实验证明乙二醇为二元醇:取62g乙二醇,加入足量金属钠充分反应,收集并测量生成的氢气的质量是2g(或其他合理答案,乙二醇与氢气的量符合正确比例即可).
9.某学生对SO2与漂粉精的反应进行实验探究:
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性、漂白性.
(3)该同学推测现象1的白雾由HCl小液滴形成,并进行如下实验验证:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a的目的是检验白雾中是否含有Cl2,排除Cl2干扰.
②有同学认为由实验a、b不能判断白雾中含有HCl,理由是白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色沉淀
(4)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HCl,无明显变化.取上层液体加氯化钡生成白色沉淀,则沉淀X是CaSO4
②用离子方程式解释现象4中黄绿色褪去的原因:Cl2+SO2+2H2O=4H++2Cl-+SO42-.
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
 | 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀, 4.黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性、漂白性.
(3)该同学推测现象1的白雾由HCl小液滴形成,并进行如下实验验证:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a的目的是检验白雾中是否含有Cl2,排除Cl2干扰.
②有同学认为由实验a、b不能判断白雾中含有HCl,理由是白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色沉淀
(4)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HCl,无明显变化.取上层液体加氯化钡生成白色沉淀,则沉淀X是CaSO4
②用离子方程式解释现象4中黄绿色褪去的原因:Cl2+SO2+2H2O=4H++2Cl-+SO42-.
6.恒温下,向一个2L的密闭容器中充入1moN2和2.6molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
此条件下,该反应达到化学平衡时,氮气的浓度为0.4mol/L,平衡常数K=0.1.
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
13.硝基苯酚是合成医药、染料、感光材料的中间体;以苯酚为原料制备硝基苯酚的步骤如下:
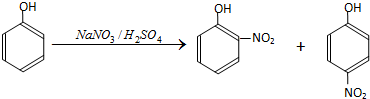
I.在常温下,向250mL三口烧瓶中加试剂(加入的试剂有:
A.50mL水;B.17.5gNaNO3;C.15mL浓硫酸
Ⅱ.称取4.7g苯酚,与1mL温水混合,并冷却至室温.
Ⅲ.在搅拌下,将苯酚水溶液自滴液漏斗滴入三口烧瓶中,将反应温度维持在20℃左右.
Ⅳ.加完苯酚后,继续搅拌1h,冷却至黑色油状物固化,倾出酸层.然后向油状物中加入20mL水并振摇,先倾出洗液,再用水洗三次,以除净残存的酸..
V.邻硝基苯酚的提纯.固化的黑色油状物主要成分是邻硝基苯酚和对硝基苯酚.
(1)步骤I中加入试剂的先后顺序为ACB(填序号)
(2)苯酚有腐蚀性,步骤Ⅱ中若不慎使苯酚触及皮肤,应立刻用酒精棉擦洗.苯酚中加少许水可降低熔点,使其中室温下即呈液态,这样操作的作用是便于滴加,同时也可以加快反应.
(3)步骤Ⅲ中,将反应温度维持在20℃左右的原因是当温度过高,一元硝基酚有可能发生进步硝化,当温度偏低,又将减缓反应速度.
(4)步骤Ⅳ中,若黑色油状物未固化,则可用分液漏斗(填实验仪器)将黑色油状物分出.
(5)根据题给信息,不使用温度计,设计步骤V得到纯净的邻硝基苯酚的实验方案;对油状混合物作水蒸气蒸馏,将馏出液冷却过滤,收集晶体,即得邻硝基苯酚产物.

I.在常温下,向250mL三口烧瓶中加试剂(加入的试剂有:
A.50mL水;B.17.5gNaNO3;C.15mL浓硫酸
Ⅱ.称取4.7g苯酚,与1mL温水混合,并冷却至室温.
Ⅲ.在搅拌下,将苯酚水溶液自滴液漏斗滴入三口烧瓶中,将反应温度维持在20℃左右.
Ⅳ.加完苯酚后,继续搅拌1h,冷却至黑色油状物固化,倾出酸层.然后向油状物中加入20mL水并振摇,先倾出洗液,再用水洗三次,以除净残存的酸..
V.邻硝基苯酚的提纯.固化的黑色油状物主要成分是邻硝基苯酚和对硝基苯酚.
| 密度 (g•mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 | 其他 | |
| 邻硝基苯酚 | 1.495 | 44.45 | 214 | 微溶于冷水,易溶于热水 | 能与水蒸气一同挥发 |
| 对硝基苯酚 | 11.481 | 113.4 | 279 | 稍溶于水 | 不与水蒸气一同挥发 |
(2)苯酚有腐蚀性,步骤Ⅱ中若不慎使苯酚触及皮肤,应立刻用酒精棉擦洗.苯酚中加少许水可降低熔点,使其中室温下即呈液态,这样操作的作用是便于滴加,同时也可以加快反应.
(3)步骤Ⅲ中,将反应温度维持在20℃左右的原因是当温度过高,一元硝基酚有可能发生进步硝化,当温度偏低,又将减缓反应速度.
(4)步骤Ⅳ中,若黑色油状物未固化,则可用分液漏斗(填实验仪器)将黑色油状物分出.
(5)根据题给信息,不使用温度计,设计步骤V得到纯净的邻硝基苯酚的实验方案;对油状混合物作水蒸气蒸馏,将馏出液冷却过滤,收集晶体,即得邻硝基苯酚产物.
11.将NO2装入带有活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,改变某个条件,下列叙述正确的是( )
| A. | 升高温度,气体颜色加深,则此反应为吸热反应 | |
| B. | 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅 | |
| C. | 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 | |
| D. | 恒温恒容时,充入惰性气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅 |