题目内容
2.下列说法正确的( )| A. | 纤维素、聚酯纤维、光导纤维都属于有机高分子 | |
| B. | 用卤水点豆腐与黄河入海口处沙洲的形成,都体现了胶体聚沉的性质 | |
| C. | 用活性炭为有色物质脱色和用漂白粉漂白有色物质,原理相似 | |
| D. | 为增强84消毒液的消毒效果,使用时可加入浓盐酸 |
分析 A.光导纤维主要成分是二氧化硅;
B.胶体遇电解质溶液发生聚沉;
C.活性炭因吸附而具有漂白性,漂白粉具有氧化性而具有漂白性;
D.加入浓盐酸,发生氧化还原反应生成氯气,减小HClO的浓度.
解答 解:A.光导纤维主要成分是二氧化硅,是无机非金属材料,不是高分子材料,故A错误;
B.黄河中的泥沙和豆浆都是胶体,胶体遇电解质溶液发生聚沉,故B正确;
C.用活性炭为蔗糖脱色,是发生吸附属于物理变化,用漂白粉漂白有色物质,是因为漂白粉具有氧化性,能够氧化有机色素,属于化学变化,二者原理不同,故C错误;
D.加入浓盐酸,发生氧化还原反应生成氯气,减小HClO的浓度,则减弱84消毒液的漂白效果,故D错误.
故选B.
点评 本题考查材料、胶体的性质、漂白性、氧化还原反应等知识,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
相关题目
12.下列物质分类不正确的是( )
| A. | 纯碱属于碱类 | B. | 漂白粉属于混合物 | ||
| C. | 醋酸属于弱电解质 | D. | 二氧化碳属于酸性氧化物 |
13.常温时,以下4种溶液pH最大的是( )
| A. | 0.01 mol•L-1氨水溶液 | |
| B. | 0.02 mol•L-1氨水与0.02 mol•L-1HCl溶液等体积混合 | |
| C. | 0.03 mol•L-1氨水与0.01 mol•L-1 HCl溶液等体积混合 | |
| D. | pH=2的盐酸与pH=12的NaOH溶液等体积混合 |
10.2006年3月5日,温家宝在十届全国人大四次会议上所作的“政府工作报告”中指出:“抓好资源节约,建设环境友好型社会”,这是我国社会及经济长期发展的重要保证.你认为下列行为中有悖于这一保证的是( )
| A. | 开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料 | |
| B. | 将煤进行气法处理,提高煤的综合利用效率 | |
| C. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用观,即:减 少资源消耗、增加资源的重复使用、奖励资源的循环再生使用 |
7.用NA 表示阿伏加德罗常数的值( )
| A. | 0.2molNa2O2 完全与水反应转移的电子数为0.4NA | |
| B. | 800mL 2mol•L-1酒精溶液中所含分子数为0.6NA | |
| C. | 常温常压下,1.6g O2和O3的混合气体所含电子书为0.8NA | |
| D. | 在常温常压下,2.24L NO2与O2混合气体中所含氧原子数为0.2NA |
14.下列关于盐类的水解反应与中和反应的说法中,正确的是( )
| A. | 二者是同一反应 | B. | 两者没有任何联系 | ||
| C. | 盐类水解反应的逆反应是中和反应 | D. | 两者互为可逆反应 |
16.下表是元素周期表的一部分:
(1)表中元素②、③、⑨的氢化物的化学式为NH3、H2O、HCl.
(2)某元素的原子结构示意图为: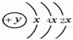 ,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
(3)写出④与⑥、④与⑧、⑥与⑨的最高价氧化物对应水化物反应的离子方程式:
④与⑥:OH-+Al(OH)3=AlO2-+2H2O
④与⑧:OH-+H+=H2O
⑥与⑨:Al(OH)3+3H+=Al3++3H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
(2)某元素的原子结构示意图为:
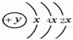 ,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.(3)写出④与⑥、④与⑧、⑥与⑨的最高价氧化物对应水化物反应的离子方程式:
④与⑥:OH-+Al(OH)3=AlO2-+2H2O
④与⑧:OH-+H+=H2O
⑥与⑨:Al(OH)3+3H+=Al3++3H2O.