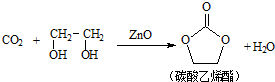题目内容
8.探究新制饱和氯水成分的实验时,由实验现象得出的结论错误的是( )| A. | 向氯水中滴加NaHCO3,有气泡产生,说明氯水中含有HCl和HClO | |
| B. | 向FeCl2溶液中滴加氯水,溶液变成棕黄色,说明氯水中含有HClO | |
| C. | 氯水呈浅黄绿色,说明氯水中含有Cl2 | |
| D. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含Cl- |
分析 溶液中存在平衡Cl2+H2O?HCl+HClO,只有氯气有颜色,为黄绿色,氯水中含有氯气而呈浅黄绿色,溶液中HCl与硝酸银反应产生AgCl白色沉淀,而溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,溶液中氯气、HClO都强氧化性,都可以将亚铁离子氧化为铁离子,而使溶液变为棕黄色.
解答 解:溶液中存在平衡Cl2+H2O?HCl+HClO,
A.溶液呈酸性,能与碳酸氢钠反应的是盐酸,反应生成二氧化碳,次氯酸酸性小于碳酸,次氯酸不和碳酸氢钠发生反应,不能证明含次氯酸,故A错误;
B.溶液中氯气、HClO都强氧化性,都可以将亚铁离子氧化为铁离子,而使溶液变为棕黄色,不能说明氯水中含有HClO,故B错误,
C.只有氯气有颜色,为黄绿色,氯水呈浅黄绿色是由于含有氯气,故C正确;
D.溶液与硝酸银反应产生白色沉淀,只能是氯离子与银离子反应得到AgCl白色沉淀,说明氯水中含有Cl-,故D正确;
故选AB.
点评 本题考查氯水的性质,难度不大,侧重对基础知识的考查,需要学生熟练掌握基础知识.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
13.常温时,以下4种溶液pH最大的是( )
| A. | 0.01 mol•L-1氨水溶液 | |
| B. | 0.02 mol•L-1氨水与0.02 mol•L-1HCl溶液等体积混合 | |
| C. | 0.03 mol•L-1氨水与0.01 mol•L-1 HCl溶液等体积混合 | |
| D. | pH=2的盐酸与pH=12的NaOH溶液等体积混合 |
14.下列关于盐类的水解反应与中和反应的说法中,正确的是( )
| A. | 二者是同一反应 | B. | 两者没有任何联系 | ||
| C. | 盐类水解反应的逆反应是中和反应 | D. | 两者互为可逆反应 |
16.下表是元素周期表的一部分:
(1)表中元素②、③、⑨的氢化物的化学式为NH3、H2O、HCl.
(2)某元素的原子结构示意图为: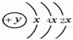 ,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
(3)写出④与⑥、④与⑧、⑥与⑨的最高价氧化物对应水化物反应的离子方程式:
④与⑥:OH-+Al(OH)3=AlO2-+2H2O
④与⑧:OH-+H+=H2O
⑥与⑨:Al(OH)3+3H+=Al3++3H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
(2)某元素的原子结构示意图为:
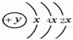 ,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.(3)写出④与⑥、④与⑧、⑥与⑨的最高价氧化物对应水化物反应的离子方程式:
④与⑥:OH-+Al(OH)3=AlO2-+2H2O
④与⑧:OH-+H+=H2O
⑥与⑨:Al(OH)3+3H+=Al3++3H2O.
20. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W的最高正价与最低负价的代数和为6,下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W的最高正价与最低负价的代数和为6,下列判断正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W的最高正价与最低负价的代数和为6,下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W的最高正价与最低负价的代数和为6,下列判断正确的是( )| A. | 原子半径:rW>rZ>rY>rX | |
| B. | Y的氧化物是酸性氧化物,不与任何酸反应 | |
| C. | 最简单气态氢化物的热稳定性:H2W>ZH4 | |
| D. | X元素的非金属性比Y元素的强 |
18.NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 在常温常压下,28 g N2含有的分子数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 标准状况下,1mol CCl4的体积约为22.4 L | |
| D. | 2.3g的金属钠变为钠离子时失去的电子数为0.1NA |
 .
.