题目内容
1.已知乙酸和乙酸乙酯的混合物中含H为7%,则其中含碳量是( )| A. | 42% | B. | 44% | C. | 48.6% | D. | 91.9% |
分析 乙酸为C2H4O2,乙酸乙酯为C4H8O2,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,根据氢元素的质量分数计算混合物中碳元素质量分数.
解答 解:乙酸为C2H4O2,乙酸乙酯为C4H8O2,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,混合物中氢元素的质量分数为7%,则混合物中碳元素的质量分数为7%×6=42%,
故选A.
点评 本题考查混合物中元素的质量分数的计算,关键是根据各成分的化学式得出C、H的固定组成,学生应学会利用定组成的方法来解答混合物中元素的质量分数计算.

练习册系列答案
相关题目
11.已知利用某些有机物之间的转代可贮存太阳能,如降冰片二烯(NBD)经太阳光照射转化成四环烷(Q)的反应为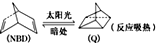 ,下列叙述中错误的是( )
,下列叙述中错误的是( )
 ,下列叙述中错误的是( )
,下列叙述中错误的是( )| A. | Q的能量高于NBD | B. | NBD和Q的分子式不同 | ||
| C. | Q的一氯代物只有3种 | D. | NBD的同分异构体可以是芳香烃 |
12.下列物质分类不正确的是( )
| A. | 纯碱属于碱类 | B. | 漂白粉属于混合物 | ||
| C. | 醋酸属于弱电解质 | D. | 二氧化碳属于酸性氧化物 |
16.现有三组混合液:(1)乙酸乙酯和乙酸钠;(2)乙醇和丁醇;(3)溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、分液、蒸馏 | C. | 萃取、蒸馏、分液 | D. | 分液、蒸馏、萃取 |
6.如图,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法正确的是( )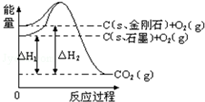

| A. | 金刚石的稳定性强于石墨 | |
| B. | 12g石墨总键能比12g金刚石小1.9kJ | |
| C. | 石墨和金刚石的转化是物理变化 | |
| D. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ/mol |
13.常温时,以下4种溶液pH最大的是( )
| A. | 0.01 mol•L-1氨水溶液 | |
| B. | 0.02 mol•L-1氨水与0.02 mol•L-1HCl溶液等体积混合 | |
| C. | 0.03 mol•L-1氨水与0.01 mol•L-1 HCl溶液等体积混合 | |
| D. | pH=2的盐酸与pH=12的NaOH溶液等体积混合 |
10.2006年3月5日,温家宝在十届全国人大四次会议上所作的“政府工作报告”中指出:“抓好资源节约,建设环境友好型社会”,这是我国社会及经济长期发展的重要保证.你认为下列行为中有悖于这一保证的是( )
| A. | 开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料 | |
| B. | 将煤进行气法处理,提高煤的综合利用效率 | |
| C. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用观,即:减 少资源消耗、增加资源的重复使用、奖励资源的循环再生使用 |
16.下表是元素周期表的一部分:
(1)表中元素②、③、⑨的氢化物的化学式为NH3、H2O、HCl.
(2)某元素的原子结构示意图为: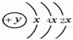 ,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
(3)写出④与⑥、④与⑧、⑥与⑨的最高价氧化物对应水化物反应的离子方程式:
④与⑥:OH-+Al(OH)3=AlO2-+2H2O
④与⑧:OH-+H+=H2O
⑥与⑨:Al(OH)3+3H+=Al3++3H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
(2)某元素的原子结构示意图为:
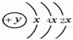 ,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.(3)写出④与⑥、④与⑧、⑥与⑨的最高价氧化物对应水化物反应的离子方程式:
④与⑥:OH-+Al(OH)3=AlO2-+2H2O
④与⑧:OH-+H+=H2O
⑥与⑨:Al(OH)3+3H+=Al3++3H2O.