题目内容
19.化学能与热能、电能等可以相互转化,关于化学能与其他能量相互转化的说法正确的是( )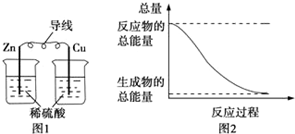
| A. | 图1所示的装置能将化学能转变为电能 | |
| B. | 图2所示的反应为吸热反应 | |
| C. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| D. | 中和反应中,反应物的总能量比生成物的总能量低 |
分析 A.图I所示的装置没形成闭合回路,不能形成原电池;
B.反应物的总能量大于生成物的总能量,该反应为放热反应;
C.化学反应时断键要吸收能量,成键要放出能量;
D.中和反应,反应物的总能量大于生成物的总能量.
解答 解:A.图I所示的装置没形成闭合回路,不能形成原电池,没有电流通过,所以不能把化学能转变为电能,故A错误;
B.图II所示的反应,反应物的总能量大于生成物的总能量,所以该反应为放热反应,故B错误;
C.化学反应时断键要吸收能量,成键要放出能量,所以化学反应中能量变化的主要原因是化学键的断裂与生成,故C正确;
D.中和反应为放热反应,反应物的总能量比生成物的总能量高,故D错误;
故选C.
点评 该题是高考中的常见题型,属于较低难度试题的考查,主要是考查学生对化学反应中能量变化对的原因、影响反应热大小因素以及原电池构成条件的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,注意相关知识的积累和总结.

练习册系列答案
相关题目
10.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快反应速率,不可以采取的措施有ABC (填序号,下同).
A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
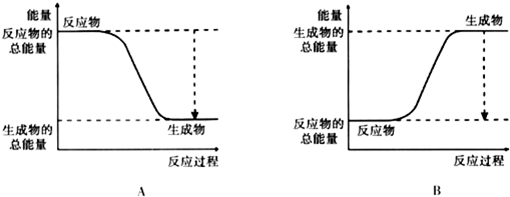
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是A
(3)从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
由此计算2mol H2在氧气中燃烧生成气态水放出的热量484kJ.
(1)为了加快反应速率,不可以采取的措施有ABC (填序号,下同).
A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是A

(3)从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
7.一定量的锌粉和2mol•L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够减小反应速率,又不影响产生H2总量的是( )
| A. | 石墨 | B. | 氧化铜 | C. | 浓盐酸 | D. | 醋酸钠固体 |
14.互为同分异构体的物质不可能具有( )
| A. | 相同的式量 | B. | 相同的结构 | C. | 相同的通式 | D. | 相同的分子式 |
4.下列各指定微粒的数目比是1:1的是( )
| A. | Na2O2溶液中阴离子和阳离子 | |
| B. | NaHSO4溶液中阳离子和阴离子 | |
| C. | ${\;}_{12}^{24}$Mg2+离子中的质子和中子 | |
| D. | 氯化钠溶液中阳离子和阴离子的电子数 |
8.下列有关化学用语或说法正确的是( )
| A. | 氯离子的结构示意图: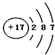 | B. | 18g18O2中含有1mol氧原子 | ||
| C. | 14N和14C是互为同位素 | D. | 氨气的电子式为: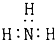 |
9.根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )


| A. | H2O分解为H2与O2时放出热量 | |
| B. | 1molH2与0.5molO2完全反应生成1mol H2O时放出热量245 kJ | |
| C. | 甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙 | |
| D. | 氢气和氧气的总能量小于水的能量 |


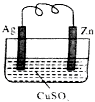 如图所示的原电池,一段时间后某极析出6.4克的固体.回答下列问题:
如图所示的原电池,一段时间后某极析出6.4克的固体.回答下列问题: