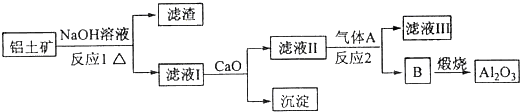
题目内容
7.一定量的锌粉和2mol•L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够减小反应速率,又不影响产生H2总量的是( )| A. | 石墨 | B. | 氧化铜 | C. | 浓盐酸 | D. | 醋酸钠固体 |
分析 酸过量、锌完全反应,锌的量决定氢气的体积,能够加快反应速率,又不影响产生H2的总量,采取措施有:形成原电池,注意形成原电池是不能消耗Zn,升高温度,改变锌粉的颗粒大小,增大氢离子的浓度等,以此解答该题.
解答 解:A、加入石墨粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故A错误;
B、加入CuO,与盐酸反应生成氯化铜,氯化铜与锌反应生成铜,形成原电池,加快反应,但与盐酸反应的锌的量减少,生成氢气的总量减少,故B错误;
C、加入浓盐酸,氢离子浓度增大,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故C错误;
D、加入醋酸钠固体,会和盐酸反应生成醋酸,氢离子浓度减小,但是物质的量不变,所以速率减慢,但是不影响产生H2总量,故D正确;
故选D.
点评 本题考查化学反应速率的影响元素,为高频考点,侧重于学生的分析能力的考查,难度中等,注意加入氧化铜对氢气的总量的影响,是本题的易错点.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
17.关于卤素(F、Cl、Br、I)的性质的叙述,错误的是( )
| A. | 卤素单质的密度逐渐增大 | |
| B. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| C. | 将氯水加到KI淀粉溶液中,溶液变蓝 | |
| D. | 它们的原子核外电子层数随核电荷数的增加而增多 |
2.某同学为检验CuS在不同酸中的溶解性,取4份黑色CuS粉末试样置于试管中,分别加入醋酸、浓盐酸、浓硫酸、浓硝酸溶液.观察到如下现象:
①CuS不溶于醋酸溶液;
②CuS不溶于浓盐酸;
③CuS不溶于浓硫酸;
④CuS在浓硝酸中溶解,溶液变蓝,并有红棕色刺激性气体产生.
根据上述现象,该同学得出了以下结论,其中正确的是( )
①CuS不溶于醋酸溶液;
②CuS不溶于浓盐酸;
③CuS不溶于浓硫酸;
④CuS在浓硝酸中溶解,溶液变蓝,并有红棕色刺激性气体产生.
根据上述现象,该同学得出了以下结论,其中正确的是( )
| A. | CuS不溶于弱酸,能溶于强酸 | |
| B. | CuS不溶于非氧化性酸,能溶于氧化性酸 | |
| C. | CuS溶于硝酸,是因为硝酸氧化性强于硫酸,S2-被氧化,使CuS溶解 | |
| D. | CuS溶于硝酸,是因为硝酸的酸性大于硫酸和盐酸的酸性,S2-结合H+,放出H2S气体,使CuS溶解 |
12.工业上获得大量的乙烯、丙烯和甲烷,采用的方法是( )
| A. | 石油分馏 | B. | 石油裂化 | C. | 石油裂解 | D. | 通过沼气池制取 |
19.化学能与热能、电能等可以相互转化,关于化学能与其他能量相互转化的说法正确的是( )
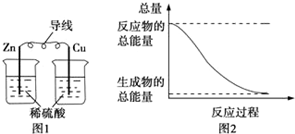

| A. | 图1所示的装置能将化学能转变为电能 | |
| B. | 图2所示的反应为吸热反应 | |
| C. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| D. | 中和反应中,反应物的总能量比生成物的总能量低 |
16.下列叙述正确的是( )
| A. | 同主族元素自上而下金属性减弱 | |
| B. | 同主族元素自上而下,得电子能力增强 | |
| C. | 同周期元素中ⅠA族元素的原子半径最小 | |
| D. | 同周期元素中ⅦA元素气态氢化物最稳定 |
17.运动员的腿部肌肉不小心挫伤,队医马上对准该运动员的受伤部位喷射一种名叫氯乙烷的药剂(沸点约为12℃)进行冷冻麻醉处理.关于氯乙烷的说法不正确的是( )
| A. | 在一定条件下能发生水解反应 | B. | 一定条件下反应可以制备乙烯 | ||
| C. | 该物质易溶于水 | D. | 该物质官能团的名称是氯原子 |
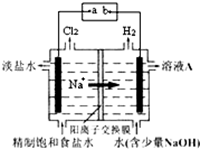 氯碱工业中电解饱和食盐水的原理示意图如图所示.
氯碱工业中电解饱和食盐水的原理示意图如图所示.