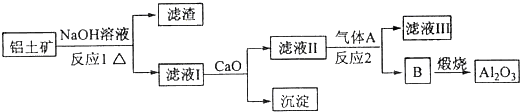
题目内容
10.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.(1)为了加快反应速率,不可以采取的措施有ABC (填序号,下同).
A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
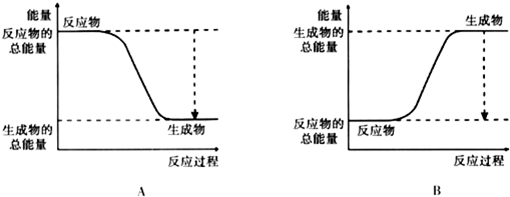
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是A
(3)从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
分析 (1)增大反应物浓度、使用催化剂、升高温度等均可加快反应速率;
(2)放热反应中反应物的总能量大于生成物的总能量;
(3)断裂化学键吸收能量,形成化学键释放能量,△H=反应物中键能之和-生成物中键能之和.
解答 解:(1)A.使用催化剂,加快反应速率,故A选;
B.适当提高氧气的浓度,反应物浓度增大,反应速率加快,故B选
C.适当提高反应的温度,反应速率加快,故C选;
D.适当降低反应的温度,反应速率减慢,故D不选;
故答案为:ABC;
(2)由图可知,A中反应物的总能量大于生成物的总能量,为放热反应,故答案为:A;
(3)断裂2molH2中的化学键吸收2×436kJ热量,断裂1molO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4molH-O键释放4×463kJ=1852kJ热量,2mol H2在氧气中燃烧生成气态水的反应热△H=反应物中键能之和-生成物中键能之和=1368-1852kJ/mol=-484kJ/mol,即2mol H2在氧气中燃烧生成气态水放出的热量为484kJ,故答案为:484kJ.
点评 本题考查较综合,涉及化学反应速率的影响因素、化学键及反应中能量变化、原电池等,为高频考点,侧重化学反应原理的考查,有利于基础知识的夯实,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.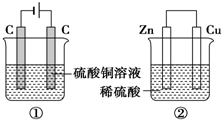 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阴极:Cu2++2e-═Cu②中正极:2H++2e-═H2↑ | |
| D. | 反应完成后溶液PH:①<7,②>7 |
1.(1)由A、B、C、D四种金属按表中装置进行实验.
根据实验现象回答下列问题:
①装置甲中负极的电极反应为A-2e-═A2+.
②装置乙中正极的电极反应为Cu2++2e-═Cu.
③装置丙中溶液的pH增大(填“增大”、“减小”或“不变”).
④四种金属活动性由强到弱的顺序为D>A>B>C.
(2)在一定温度下,反应2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)达到平衡状态时,n(SO2):n(O2):n (SO3)=2:3:4.缩小体积,再次达到平衡状态时,n(O2)=0.8mol,n(SO3)=1.4mol,下列说法正确的是AB.
A.再次达到平衡状态时,n(SO2)为0.4mol B.缩小体积,再次达到平衡过程中,v正>v逆
C.使用催化剂对反应速率影响不大 D.工业上一般采用增加SO2的浓度来提高O2的转化率.
| 实验装置 | 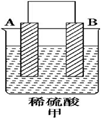 |  | 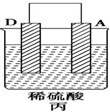 |
| 部分实验现象 | A(二价金属)不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中负极的电极反应为A-2e-═A2+.
②装置乙中正极的电极反应为Cu2++2e-═Cu.
③装置丙中溶液的pH增大(填“增大”、“减小”或“不变”).
④四种金属活动性由强到弱的顺序为D>A>B>C.
(2)在一定温度下,反应2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)达到平衡状态时,n(SO2):n(O2):n (SO3)=2:3:4.缩小体积,再次达到平衡状态时,n(O2)=0.8mol,n(SO3)=1.4mol,下列说法正确的是AB.
A.再次达到平衡状态时,n(SO2)为0.4mol B.缩小体积,再次达到平衡过程中,v正>v逆
C.使用催化剂对反应速率影响不大 D.工业上一般采用增加SO2的浓度来提高O2的转化率.
5.结合元素周期表和周期律的相关知识,判断下列说法正确的是( )
| A. | 短周期主族元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
2.某同学为检验CuS在不同酸中的溶解性,取4份黑色CuS粉末试样置于试管中,分别加入醋酸、浓盐酸、浓硫酸、浓硝酸溶液.观察到如下现象:
①CuS不溶于醋酸溶液;
②CuS不溶于浓盐酸;
③CuS不溶于浓硫酸;
④CuS在浓硝酸中溶解,溶液变蓝,并有红棕色刺激性气体产生.
根据上述现象,该同学得出了以下结论,其中正确的是( )
①CuS不溶于醋酸溶液;
②CuS不溶于浓盐酸;
③CuS不溶于浓硫酸;
④CuS在浓硝酸中溶解,溶液变蓝,并有红棕色刺激性气体产生.
根据上述现象,该同学得出了以下结论,其中正确的是( )
| A. | CuS不溶于弱酸,能溶于强酸 | |
| B. | CuS不溶于非氧化性酸,能溶于氧化性酸 | |
| C. | CuS溶于硝酸,是因为硝酸氧化性强于硫酸,S2-被氧化,使CuS溶解 | |
| D. | CuS溶于硝酸,是因为硝酸的酸性大于硫酸和盐酸的酸性,S2-结合H+,放出H2S气体,使CuS溶解 |
19.化学能与热能、电能等可以相互转化,关于化学能与其他能量相互转化的说法正确的是( )
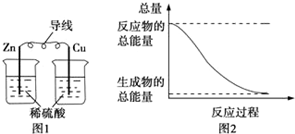

| A. | 图1所示的装置能将化学能转变为电能 | |
| B. | 图2所示的反应为吸热反应 | |
| C. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| D. | 中和反应中,反应物的总能量比生成物的总能量低 |
20.锗(Ge)、锡(Sn)、铅是第ⅣA元素,三种单质的熔点依次为1211℃、232℃、237.5℃.下列关于它们单质和化合物性质的说法不正确的是( )
| A. | 熔点:GeCl4<NaCl | |
| B. | 酸性:Ge(OH)4>Sn(OH)4>Pb(OH)4 | |
| C. | 相同条件下,锗、锡、铅单质分别与稀硫酸反应,速率依次减慢 | |
| D. | 常温下在空气中,锗单质不被氧化,铅单质表面生成一层保护薄膜 |
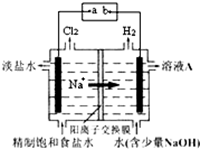 氯碱工业中电解饱和食盐水的原理示意图如图所示.
氯碱工业中电解饱和食盐水的原理示意图如图所示.