题目内容
9.有机化学中的反应类型较多,将下列反应归类(填序号).①乙烷在空气中燃烧 ②由乙炔制氯乙烯
③甲烷与氯气在光照的条件下反应 ④乙烯使酸性高锰酸钾溶液褪色
⑤乙烯使溴的四氯化碳溶液褪色 ⑥实验室制乙烯
⑦由甲苯制取TNT ⑧溴乙烷和氢氧化钠的乙醇溶液共热
⑨乙苯的制备:

(1)其中属于取代反应的是③⑦;属于氧化反应的是①④;
(2)写出⑦和⑧的化学方程式:
⑦

⑧CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O.
分析 (1)有机物中的原子或原子团被其它的原子或原子团所代替的反应为取代反应;有机物的燃烧、碳碳不饱和键被氧化的反应都属于氧化反应;
(2)在浓硫酸作催化剂、加热条件下,甲苯和浓硝酸发生取代反应生成三硝基甲苯;
在加热条件下,溴乙烷和氢氧化钠的醇溶液发生消去反应生成乙烯.
解答 解:(1)有机物中的原子或原子团被其它的原子或原子团所代替的反应为取代反应;有机物的燃烧、碳碳不饱和键被氧化的反应都属于氧化反应,属于取代反应的有③⑦,属于氧化反应的有①④,
故答案为:③⑦;①④;
(2)在浓硫酸作催化剂、加热条件下,甲苯和浓硝酸发生取代反应生成三硝基甲苯,反应方程式为 ;
;
在加热条件下,溴乙烷和氢氧化钠的醇溶液发生消去反应生成乙烯,反应方程式为CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O,
故答案为: ;CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O.
;CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O.
点评 本题考查有机物反应、化学方程式的书写等知识点,明确官能团及其性质关系是解本题关键,知道常见反应类型特点,注意:水解反应、酯化反应、硝化反应、磺化反应都属于取代反应.

练习册系列答案
相关题目
20.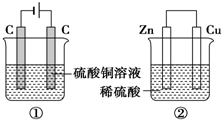 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阴极:Cu2++2e-═Cu②中正极:2H++2e-═H2↑ | |
| D. | 反应完成后溶液PH:①<7,②>7 |
17.关于卤素(F、Cl、Br、I)的性质的叙述,错误的是( )
| A. | 卤素单质的密度逐渐增大 | |
| B. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| C. | 将氯水加到KI淀粉溶液中,溶液变蓝 | |
| D. | 它们的原子核外电子层数随核电荷数的增加而增多 |
1.(1)由A、B、C、D四种金属按表中装置进行实验.
根据实验现象回答下列问题:
①装置甲中负极的电极反应为A-2e-═A2+.
②装置乙中正极的电极反应为Cu2++2e-═Cu.
③装置丙中溶液的pH增大(填“增大”、“减小”或“不变”).
④四种金属活动性由强到弱的顺序为D>A>B>C.
(2)在一定温度下,反应2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)达到平衡状态时,n(SO2):n(O2):n (SO3)=2:3:4.缩小体积,再次达到平衡状态时,n(O2)=0.8mol,n(SO3)=1.4mol,下列说法正确的是AB.
A.再次达到平衡状态时,n(SO2)为0.4mol B.缩小体积,再次达到平衡过程中,v正>v逆
C.使用催化剂对反应速率影响不大 D.工业上一般采用增加SO2的浓度来提高O2的转化率.
| 实验装置 | 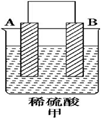 |  | 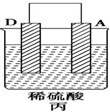 |
| 部分实验现象 | A(二价金属)不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中负极的电极反应为A-2e-═A2+.
②装置乙中正极的电极反应为Cu2++2e-═Cu.
③装置丙中溶液的pH增大(填“增大”、“减小”或“不变”).
④四种金属活动性由强到弱的顺序为D>A>B>C.
(2)在一定温度下,反应2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)达到平衡状态时,n(SO2):n(O2):n (SO3)=2:3:4.缩小体积,再次达到平衡状态时,n(O2)=0.8mol,n(SO3)=1.4mol,下列说法正确的是AB.
A.再次达到平衡状态时,n(SO2)为0.4mol B.缩小体积,再次达到平衡过程中,v正>v逆
C.使用催化剂对反应速率影响不大 D.工业上一般采用增加SO2的浓度来提高O2的转化率.
19.化学能与热能、电能等可以相互转化,关于化学能与其他能量相互转化的说法正确的是( )
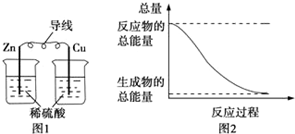

| A. | 图1所示的装置能将化学能转变为电能 | |
| B. | 图2所示的反应为吸热反应 | |
| C. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| D. | 中和反应中,反应物的总能量比生成物的总能量低 |
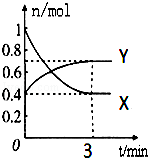 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.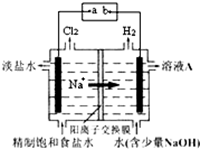 氯碱工业中电解饱和食盐水的原理示意图如图所示.
氯碱工业中电解饱和食盐水的原理示意图如图所示.