题目内容
9.根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
| A. | H2O分解为H2与O2时放出热量 | |
| B. | 1molH2与0.5molO2完全反应生成1mol H2O时放出热量245 kJ | |
| C. | 甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙 | |
| D. | 氢气和氧气的总能量小于水的能量 |
分析 上图表示了1mol氢气和0.5mol氧气反应生成1mol水的过程中的能量变化,断键吸收能量,成键释放能量,△H=反应物键能和-生成物键能和,据此解答.
解答 解:A、△H=反应物键能和-生成物键能和=436KJ/mol+249KJ/mol-930KJ/mol=-245KJ/mol,反应放热,所以水分解吸热,故A错误;
B、据A分析,生成1mol水时放出245KJ的热量,故B正确;
C、断键吸收能量,成键释放能量,甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙,故C错误;
D、反应放热,反应物总能量高于生成物,氢气和氧气的总能量大于水的能,故D错误;
故选B.
点评 本题考查了氢气和氧气生成水的过程中的能量变化,注意△H=反应物键能和-生成物键能和,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.化学能与热能、电能等可以相互转化,关于化学能与其他能量相互转化的说法正确的是( )
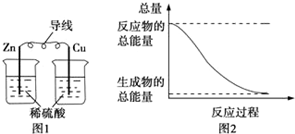

| A. | 图1所示的装置能将化学能转变为电能 | |
| B. | 图2所示的反应为吸热反应 | |
| C. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| D. | 中和反应中,反应物的总能量比生成物的总能量低 |
20.锗(Ge)、锡(Sn)、铅是第ⅣA元素,三种单质的熔点依次为1211℃、232℃、237.5℃.下列关于它们单质和化合物性质的说法不正确的是( )
| A. | 熔点:GeCl4<NaCl | |
| B. | 酸性:Ge(OH)4>Sn(OH)4>Pb(OH)4 | |
| C. | 相同条件下,锗、锡、铅单质分别与稀硫酸反应,速率依次减慢 | |
| D. | 常温下在空气中,锗单质不被氧化,铅单质表面生成一层保护薄膜 |
17.运动员的腿部肌肉不小心挫伤,队医马上对准该运动员的受伤部位喷射一种名叫氯乙烷的药剂(沸点约为12℃)进行冷冻麻醉处理.关于氯乙烷的说法不正确的是( )
| A. | 在一定条件下能发生水解反应 | B. | 一定条件下反应可以制备乙烯 | ||
| C. | 该物质易溶于水 | D. | 该物质官能团的名称是氯原子 |
14.已知:物质的能量越低越稳定,白磷转化为红磷是放热的,据此下列说法中正确的是( )
| A. | 白磷转化为红磷是物理变化 | |
| B. | 在相同条件下红磷比白磷稳定 | |
| C. | 相同条件下,红磷所具有的总能量比白磷的高 | |
| D. | 相同质量的红磷和白磷完全燃烧放出的能量相等 |
1.下列物质属于含有共价键的离子化合物是( )
| A. | Na2O | B. | CaCl2 | C. | NaOH | D. | H2SO4 |
18.下列排列有错误的是( )
| A. | 粒子半径:Al3+>Mg2+>Na+>F- | B. | 碱性:Al(OH)3<Mg(OH)2<Ca(OH)2<KOH | ||
| C. | 酸性:H4SiO4<H3PO4<H2SO4<HClO4 | D. | 稳定性:HF>HCl>HBr>HI |
19.下列性质中,可以用来证明某化合物一定是离子化合物的是( )
| A. | 可溶于水 | B. | 水溶液能导电 | C. | 熔融状态能导电 | D. | 具有较高的熔点 |

 (写结构简式).
(写结构简式).