题目内容
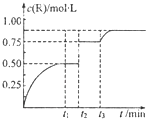 一定温度下,将1molN气体充入2L恒容密闭容器中,发生反应:M(g)+N(g)?xR(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体R的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1molN气体充入2L恒容密闭容器中,发生反应:M(g)+N(g)?xR(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体R的浓度随时间变化如图所示.下列说法正确的是( )| A、该反应方程式中:x=1 |
| B、t1~t3间该反应的平衡常系数均为4 |
| C、t2时刻改变的条件是使用催化剂 |
| D、t3时刻改变的条件是移去少量Q |
考点:物质的量或浓度随时间的变化曲线
专题:
分析:A、由图可知,t2时刻Z的浓度增大,但平衡不移动,故改变的条件应是增大压强,反应前后气体的化学计量数之和相等;
B、t1~t3间温度相同,利用三段式计算t1平衡时各物质的浓度,代入平衡常数表达式计算;
C、催化剂不能影响物质的浓度;
D、Q是固体,改变Q的用量,不影响平衡移动,t3时刻改变的条件,瞬间Z的浓度不变,平衡向正反应移动,可能是增大反应物的浓度或升高温度.
B、t1~t3间温度相同,利用三段式计算t1平衡时各物质的浓度,代入平衡常数表达式计算;
C、催化剂不能影响物质的浓度;
D、Q是固体,改变Q的用量,不影响平衡移动,t3时刻改变的条件,瞬间Z的浓度不变,平衡向正反应移动,可能是增大反应物的浓度或升高温度.
解答:
解:A、由图可知,t2时刻Z的浓度增大,但平衡不移动,故改变的条件应是增大压强,反应前后气体的化学计量数之和相等,故x=1+1=2,故A错误;
B、t1~t3间温度相同,由图可知t1时刻平衡时,c(Z)=0.5mol/L,则:
X(g)+Y(g)?2Z(g)+Q(s),
开始(mol/L):0.5 0.5 0
变化(mol/L):0.25 0.25 0.5
平衡(mol/L):0.25 0.25 0.5
故平衡常数为
=4,故B正确;
C、催化剂不能影响物质的浓度,由图可知,t2时刻Z的浓度增大,但平衡不移动,故改变的条件应是增大压强,故C错误;
D、Q是固体,改变Q的用量,不影响平衡移动,t3时刻改变的条件,瞬间Z的浓度不变,平衡向正反应移动,可能是增大反应物的浓度或升高温度,故D错误;
故选B.
B、t1~t3间温度相同,由图可知t1时刻平衡时,c(Z)=0.5mol/L,则:
X(g)+Y(g)?2Z(g)+Q(s),
开始(mol/L):0.5 0.5 0
变化(mol/L):0.25 0.25 0.5
平衡(mol/L):0.25 0.25 0.5
故平衡常数为
| 0.5×0.5 |
| 0.25×0.25 |
C、催化剂不能影响物质的浓度,由图可知,t2时刻Z的浓度增大,但平衡不移动,故改变的条件应是增大压强,故C错误;
D、Q是固体,改变Q的用量,不影响平衡移动,t3时刻改变的条件,瞬间Z的浓度不变,平衡向正反应移动,可能是增大反应物的浓度或升高温度,故D错误;
故选B.
点评:本题考查化学平衡有关计算、化学平衡图象等,难度中等,判断t2时刻改变条件是关键,注意把握三段式在化学平衡计算中的应用.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
下列实验设计及其对应的离子反应方程式正确的是( )
A、用惰性电极电解MgCl2 溶液:2Cl-+2H2O
| ||||
| B、用浓盐酸酸化的高锰酸钾溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | ||||
| C、向NH4Al(SO4)2溶液中逐滴加入过量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3?H2O | ||||
| D、向澄清石灰水中滴加同浓度的少量碳酸氢钙溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
关于工业转化图(见图),下列说法不正确的是( )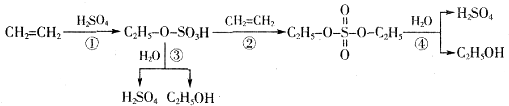

| A、该过程是一种“对环境友好型”工业生产硫酸的方法 |
| B、从以上物质的转化过程可看出硫酸可作乙烯水化法制乙醇的催化剂 |
| C、该过程中①②是加成反应 |
| D、该过程中③④是酯类的水解 |
制取一氯乙烷最好采用的方法是( )
| A、乙烷和氯气反应 |
| B、乙烯和氯气反应 |
| C、乙烯和氯化氢反应 |
| D、乙烯和氯气、氢气反应 |
化学无处不在,下列与化学有关说法正确的是( )
| A、中性溶液的PH都相等 | ||||
| B、新型净水材料高铁酸钠是生产自来水理想的净水剂和杀菌剂 | ||||
C、
| ||||
| D、△H<0,△S<0的化学反应不能自发进行 |
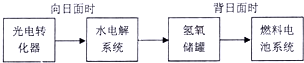
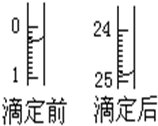 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.