题目内容
2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举.火箭升空需要高能燃料,通常用(N2H4)作为燃料,N2O4做氧化剂,请回答下列问题:
(1)工业上用次氯酸钠与过量的氨气反应制备,该反应的化学方程式为
(2)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
写出气态在气态四氧化氮中燃烧生成氮气和气态水的热化学方程式:
(3)如图是“玉兔号:中能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液.若某段时间内水电解系统中转移电子的物质的量为2mol,则该段时间内氢氧储罐中可收集到气体 L(折算成标准状况);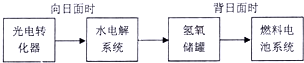
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2,某种电化学装置
可实现如下转化:2CO2=2CO+O2,同时将CO用作燃料,已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应为 .
(1)工业上用次氯酸钠与过量的氨气反应制备,该反应的化学方程式为
(2)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
写出气态在气态四氧化氮中燃烧生成氮气和气态水的热化学方程式:
(3)如图是“玉兔号:中能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液.若某段时间内水电解系统中转移电子的物质的量为2mol,则该段时间内氢氧储罐中可收集到气体

(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2,某种电化学装置
可实现如下转化:2CO2=2CO+O2,同时将CO用作燃料,已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应为
考点:热化学方程式,化学电源新型电池
专题:基本概念与基本理论
分析:(1)次氯酸钠与过量的氨气反应制备肼,依据原子守恒写出化学方程式;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)转移2mol电子,据电解方程式计算生成气体体积;
(4)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式.
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)转移2mol电子,据电解方程式计算生成气体体积;
(4)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式.
解答:
解:(1)次氯酸钠与过量的氨气反应制备肼,依据原子守恒写出化学方程式为:NaClO+2NH3=N2H4+NaCl+H2O,故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
(2)①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ?mol-1
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ?mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
据盖斯定律,②×2-(①+③)得到2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0 kJ?mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0 kJ?mol-1;
(3)电解方程式为2H2O
2H2↑+O2↑,转移电子2mol生成1mol氢气,则生成1mol氢气和0.5mol氧气,1.5mol气体在标准状况下的体积为33.6L,故答案为:33.6;
(4)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,
故答案为:2CO2+4e-+2H2O=2CO+4OH-.
(2)①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ?mol-1
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ?mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
据盖斯定律,②×2-(①+③)得到2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0 kJ?mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0 kJ?mol-1;
(3)电解方程式为2H2O
| ||
(4)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,
故答案为:2CO2+4e-+2H2O=2CO+4OH-.
点评:本题考查了氧化还原反应方程式书写、盖斯定律应用、电解计算和电极反应式书写,注意把握电极方程式的书写方法,根据电解方程式判断生成的气体的量,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
A、按系统命名法,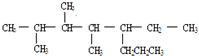 命名为2,3,4-三甲基-5-丙基庚烷 命名为2,3,4-三甲基-5-丙基庚烷 |
| B、邻羟基苯甲醛和对羟基苯甲醛是同分异构体,但邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高 |
C、塑化剂的种类很多,其中一种塑化剂的结构简式如图所示.可知该塑化剂该塑化剂在人体内会彻底水解产生2种有机物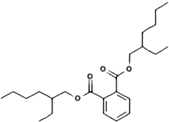 |
D、用甘氨酸(HN2-CH2-COOH)和丙氨酸(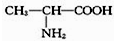 )缩合最多可形成3种二肽 )缩合最多可形成3种二肽 |
下列物质间的转化在给定条件下能够实现的是( )
①Al2O3
NaAlO2(aq)或Na[Al(OH)4](aq)
Al(OH)3
②S
SO3
H2SO4
③NaOH(aq)
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq)
无水FeCl3
⑤NH4Cl(s)
NH3
NH4HCO3.
①Al2O3
| NaOH(aq) |
| △ |
| CO2 |
②S
| O2 |
| 点燃 |
| H2O |
③NaOH(aq)
| 足量CO2 |
| △ |
④Fe2O3
| HCl(aq) |
| △ |
⑤NH4Cl(s)
| 熟石灰 |
| △ |
| H2O、CO2 |
| A、①③⑤ | B、②③④ |
| C、②④⑤ | D、①④⑤ |
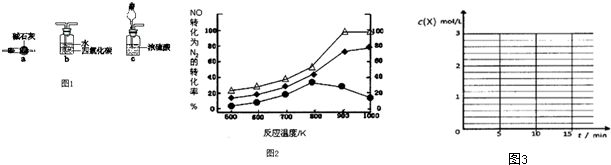
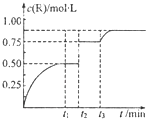 一定温度下,将1molN气体充入2L恒容密闭容器中,发生反应:M(g)+N(g)?xR(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体R的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1molN气体充入2L恒容密闭容器中,发生反应:M(g)+N(g)?xR(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体R的浓度随时间变化如图所示.下列说法正确的是( )| A、该反应方程式中:x=1 |
| B、t1~t3间该反应的平衡常系数均为4 |
| C、t2时刻改变的条件是使用催化剂 |
| D、t3时刻改变的条件是移去少量Q |
已知2Cu(NO3)2
2CuO+4NO2↑+O2↑;已知带火星的木条在空气中不能复燃,但伸进分解产生的混合气体中,木条能复燃,分析说明( )
| ||
| A、NO2具有氧化性 |
| B、NO2具有还原性 |
| C、NO2不发生反应 |
| D、只有O2才能燃烧 |
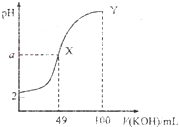 常温下向100mL0.1mol?L-1HA溶液中逐滴加入0.2mol?L-1KOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计),已知X点溶液呈中性.下列说法中,不正确的是( )
常温下向100mL0.1mol?L-1HA溶液中逐滴加入0.2mol?L-1KOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计),已知X点溶液呈中性.下列说法中,不正确的是( )| A、HA为一元弱酸 |
| B、X点溶液的温度高于Y点 |
| C、X点水的电离程度大于Y点水的电离程度 |
| D、Y点对应点的溶液中c(K+)>c(A-)>c(OH-) |
下列物质中属于非电解质的是( )
| A、H2 |
| B、氨水 |
| C、CO2 |
| D、H2SO4 |