题目内容
1.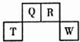 短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )
短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )| A. | 元素T和W各自形成的简单离子都能促进水的电离 | |
| B. | 元素Q的含氧酸一定是二元弱酸 | |
| C. | 简单离子半径:W>T>R | |
| D. | 常温下,T的单质能溶于R的最高价氧化物的水化物的浓溶液中 |
分析 由短周期元素Q、R、T、W在元素周期表中的位置,可知Q、R处于第二周期,T、W处于第三周期,T所处的周期序数与主族序数相等,则T为Al,可推知Q为C元素、R为N元素、W为S元素,据此结合元素化合物的性质和元素周期律解答.
解答 解:由短周期元素Q、R、T、W在元素周期表中的位置,可知Q、R处于第二周期,T、W处于第三周期,T所处的周期序数与主族序数相等,则T为Al,可推知Q为C元素、R为N元素、W为S元素,
A.铝离子水解溶液显酸性,硫离子水解显碱性,所以元素T和W各自形成的简单离子都能促进水的电离,故A正确;
B.C元素形成的含氧酸有多种,其中HCOOH为一元酸弱酸,故B错误;
C.电子层越多,离子半径越大,电子层相同的离子,原子序数越大,离子半径越小,所以简单离子半径:W>R>T,故C错误;
D.常温下,Al在浓硫酸中会钝化,所以Al在浓硫酸中不能溶解,故D错误.
故选A.
点评 本题考查结构性质位置关系应用,难度不大,注意掌握微粒半径比较、盐的水解原理、元素化合物的性质,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列有关工业生产叙述正确的是( )
| A. | 合成氨工业中,将NH3及时液化分离有利于提高产率 | |
| B. | 工业上通常使用电解法制备金属钠、镁、铝、铁等 | |
| C. | 硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 | |
| D. | 电解精炼铜时,将粗铜与电源的负极相连 |
9.某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.下列判断不正确的是( )
| A. | ClO-被还原 | |
| B. | 消耗1mol还原剂,转移3mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
16.某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理也没有NH3放出,则关于此化合物的说法中正确的是( )
| A. | Cl-和NH3分子均为内界 | B. | 该配合物可能是平面正方形结构 | ||
| C. | 配合物中心Pt4+的配位数为4 | D. | 该配合物中有离子键 |
13.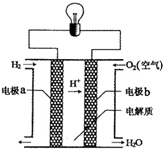 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )| A. | 该电池工作时电能转化为化学能 | |
| B. | 该电池中电极b是负极 | |
| C. | 外电路中电子由电极b通过导线流向电极a | |
| D. | 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
10.下列说法不正确的是( )
| A. | 石油分馏可获得汽油、煤油等矿物油,煤焦油干馏可获得苯、甲苯等有机物 | |
| B. | 使用“燃煤固硫”、“汽车尾气催化净化”等可减少空气污染 | |
| C. | 汽油、煤油、大豆油中所含主要成分均为烃类 | |
| D. | 硬脂酸甘油酯在碱性条件下的水解属于皂化反应 |
11.已知反应X+Y=M+N为放热反应,对这个反应的下列说法中正确的是( )
| A. | X的能量一定高于M的能量 | |
| B. | 因为该反应为放热反应,故不需要加热就能进行 | |
| C. | X和Y的总能量一定低于M和N的总能量 | |
| D. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |

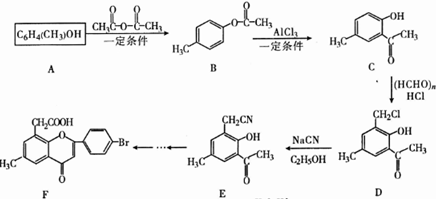
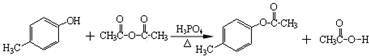
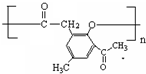 .
.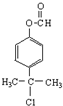 、
、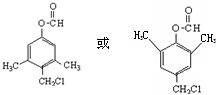 .
.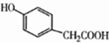 )的路线
)的路线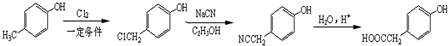 .
.