题目内容
16.某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理也没有NH3放出,则关于此化合物的说法中正确的是( )| A. | Cl-和NH3分子均为内界 | B. | 该配合物可能是平面正方形结构 | ||
| C. | 配合物中心Pt4+的配位数为4 | D. | 该配合物中有离子键 |
分析 配合物也叫络合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成;
溶液中能与银离子反应生成沉淀的是在外界的离子,实验式为PtCl4•2NH3的物质,其水溶液不导电说明它不是离子化合物,在溶液中不能电离出阴、阳离子,加入AgNO3不产生沉淀,用强碱处理没有NH3放出,说明不存在游离的氯离子和氨分子,所以该物质的配位化学式为[PtCl4(NH3)2].
解答 解:A.用强碱处理没有NH3放出,说明NH3分子配位,加入AgNO3不产生沉淀,说明Cl-配位,Cl-和NH3分子均与Pt4+配位,形成的配合物为[PtCl4(NH3)2],Cl-和NH3分子均为内界,故A正确;
B.该配合物应是8面体结构,Pt与6个配体成键,故B错误;
C.配合物中中心原子的电荷数电荷数为4,配位数为6,故C错误;
D.该物质的配位化学式为[PtCl4(NH3)2],存在铂离子和氨气之间的配位键,不存在游离的氯离子和氨分子,无离子键,故D错误;
故选A.
点评 本题考查配合物知识,题目难度中等,解答本题的关键是能正确把握题给信息,注意配合物的形成特点.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
7.一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )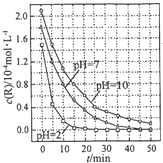

| A. | 在0-50min之间,pH=2 和 pH=7 时 R 的降解百分率相等 | |
| B. | 溶液酸性越强,R 的降解速率越小 | |
| C. | R的起始浓度越小,降解速率越大 | |
| D. | 在 20-25min之间,pH=10 时 R 的平均降解速率为 0.04mol•L-1•min-1 |
11.用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1盐酸和HX溶液,溶液的PH随加入NaOH溶液体积变化如图所示.下列说法正确的是( )

| A. | HX是弱酸,其c(OH-)是该盐酸中c(OH-)的104倍 | |
| B. | N点的pH>7的原因是由于NaOH过量所致 | |
| C. | M点c(HX)<c(X-) | |
| D. | P点c(Cl-)=0.05mol•L-1 |
1.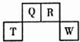 短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )
短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )
 短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )
短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )| A. | 元素T和W各自形成的简单离子都能促进水的电离 | |
| B. | 元素Q的含氧酸一定是二元弱酸 | |
| C. | 简单离子半径:W>T>R | |
| D. | 常温下,T的单质能溶于R的最高价氧化物的水化物的浓溶液中 |
8.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH+4)>c(H+)>c(OH-) | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 | |
| D. | 将pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合,所得溶液的pH一定大于7 |
 X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题:
X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题: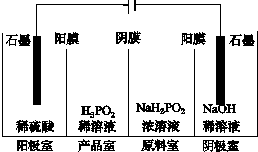 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题: