题目内容
11.在一定条件下可实现如图所示物质之间的变化:
请填写以下空白:
(1)孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解.上图中的A是NaAlO2
(2)F是CO2.过量的F与A反应的离子方程式是AlO2-+CO2+H2O=Al(OH)3↓+HCO3-
(3)写出明矾溶液与过量NaOH溶液反应的离子方程式:Al3++4OH-=AlO2-+2H2O.
(4)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式:3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3.
(5)每生成1mol D,同时生成0.75mol E.
分析 孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解的产物为氧化铜、水、二氧化碳,明矾的主要成分是KAl(SO4)2•12H2O,其中的铝离子能和过量NaOH溶液反应生成偏铝酸钠水溶液,所以A为NaAlO2,碱式碳酸铜受热易分解的产物中,只有二氧化碳可以和A反应,所以F为CO2,G为氧化铜,B为氢氧化铝受热分解的产物之一,为氧化铝,电解产物为铝和氧气,D为 Al,E为O2,
(1)孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解的产物为氧化铜、水、二氧化碳;明矾的主要成分是KAl(SO4)2•12H2O,铝离子能和过量NaOH溶液反应;
(2)A为NaAlO2,碱式碳酸铜受热易分解的产物中,只有二氧化碳可以和A反应,所以F为CO2,过量二氧化碳通入偏铝酸钠溶液生成氢氧化铝沉淀和碳酸氢钠;
(3)明矾溶液与过量NaOH溶液反应的实质是:铝离子和氢氧根之间的反应才偏铝酸钠;
(4)铝单质在高温下能置换出氧化铜中的铜;
(5)工业上采用电解熔融的氧化铝的方法来制取铝,反应方程式为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,据此化学反应定量关系计算.
解答 解:孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解的产物为氧化铜、水、二氧化碳,明矾的主要成分是KAl(SO4)2•12H2O,其中的铝离子能和过量NaOH溶液反应生成偏铝酸钠水溶液,所以A为:NaAlO2,碱式碳酸铜受热易分解的产物中,只有二氧化碳可以和A反应,所以F为CO2,G为氧化铜,B为氢氧化铝受热分解的产物之一,为氧化铝,电解产物为铝和氧气,D为 Al,E为O2,
(1)孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),受热易分解的产物为氧化铜、水、二氧化碳,明矾的主要成分是KAl(SO4)2•12H2O,其中的铝离子能和过量NaOH溶液反应生成偏铝酸钠水溶液,所以A为:NaAlO2,
故答案为:NaAlO2;
(2)碱式碳酸铜受热易分解的产物中,只有二氧化碳可以和A为NaAlO2溶液反应,所以F为CO2,过量二氧化碳通入偏铝酸钠溶液生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+H2O=Al(OH)3↓+HCO3-,
故答案为:CO2;AlO2-+CO2+H2O=Al(OH)3↓+HCO3-;
(3)明矾溶液与过量NaOH溶液反应的实质是:铝离子和氢氧根之间的反应,离子方程式为:Al3++4OH-=AlO2-+2H2O,
故答案为:Al3++4OH-=AlO2-+2H2O;
(4)G为氧化铜,B为氢氧化铝受热分解的产物之一,为氧化铝,电解产物为铝和氧气,D为 Al,铝和氧化铜高温下的反应为:3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3,
故答案为:3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3 ;
(5)电解熔融的氧化铝的方法来制取铝,反应方程式为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,每生成1摩铝,同时生成0.75mol的氧气,
故答案为:0.75.
点评 本题主要考查了学生常见物质的性质,要求学生熟记教材知识,中等难度,答题时注意元素化合物知识的灵活运用.

 阅读快车系列答案
阅读快车系列答案| A. | 单质碘 | B. | 氯化钠 | C. | 水 | D. | 氢气 |
| A. | c(Cl-)=c(CH3COO-)的盐酸和醋酸溶液 | |
| B. | 水的电离程度相同的稀硫酸和盐酸 | |
| C. | 水的电离程度相同的氯化按溶液和硫酸铜溶液 | |
| D. | 铵根离子浓度相同的硫酸铵和硫酸氢铵溶液 |
①加成反应②氧化反应③加氢反应④消去反应⑤取代反应⑥水解反应⑦酯化反应⑧加聚反应.
| A. | ①③④⑤ | B. | ③⑦⑧ | C. | ④⑥⑧ | D. | ①④⑥ |
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. |  1,3,4-三甲苯 1,3,4-三甲苯 | ||
| C. | CH3CH2CH(OH)CH3 2-丁醇 | D. |  2-甲基-3-丁炔 2-甲基-3-丁炔 |
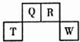 短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )
短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )| A. | 元素T和W各自形成的简单离子都能促进水的电离 | |
| B. | 元素Q的含氧酸一定是二元弱酸 | |
| C. | 简单离子半径:W>T>R | |
| D. | 常温下,T的单质能溶于R的最高价氧化物的水化物的浓溶液中 |
 X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题:
X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题: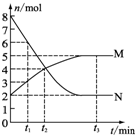 一定温度下,在容积为V L的密闭容器中进行aN(g)?bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行aN(g)?bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示: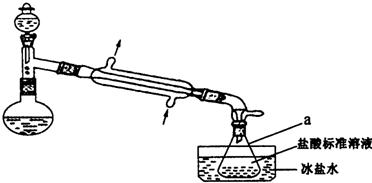 某实验小组以CoCl2•6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,他们进行了如下实验:
某实验小组以CoCl2•6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,他们进行了如下实验: