题目内容
4.下列叙述中正确的是( )| A. | 共价化合物中原子都一定满足最外层8电子结构 | |
| B. | 通过共价键形成的分子一定是共价化合物 | |
| C. | 共价化合物中可能含有离子键 | |
| D. | 微粒间通过共价键形成的晶体,具有较高的熔、沸点 |
分析 A.共价化合物中各原子不一定都满足8电子稳定结构;
B、氢气是共价键形成的分子,但是单质,不是化合物;
C、只含共价键的化合物是共价化合物;
D.由原子间通过共价键形成的晶体可能是分子晶体也可能是原子晶体.
解答 解:A.共价化合物中各原子不一定都满足8电子稳定结构,如氢化物等,故A错误;
B、氢气是共价键形成的分子,但是单质,不是化合物,故B错误;
C、只含共价键的化合物是共价化合物,所以共价化合物中不可能含有离子键,故C错误;
D.由原子间通过共价键形成的晶体可能是分子晶体也可能是原子晶体,共价键的键能较大,具有较高的熔、沸点,故D正确;
故选D.
点评 本题考查化学键的强弱、化学键的概念等知识点,侧重考查基本概念,注意不共价键形成的分子不一定是共价化合物.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
15.化学反应 A2+B2=2AB 的能量变化如图所示,则下列说法正确的是( )

| A. | 该反应是吸热反应 | |
| B. | 断裂 1 mol A-A 键和 1 mol B-B 键放出 x kJ 的能量 | |
| C. | 断裂 2 mol A-B 键需要吸收 y kJ 的能量 | |
| D. | 2 mol AB 的总能量大于1 mol A2 和 1 mol B2 的总能量 |
19.A,B,C,D,E,F,G为7种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下,其中:B的离子半径大于E的离子半径;D是由极性键构成的4原子分子;C与F可形成D和G分子.
(1)A粒子的结构示意图是 .
.
(2)用电子式表示D的形成过程:
(3)比较B与E相应元素的最高价氧化物对应水化物的碱性强弱,为NaOH>Mg(OH)2(用化学式表示).
(4)D与G反应的化学方程式是NH3+H2O═NH3•H2O.
(5)C粒子是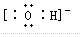 ,F粒子是
,F粒子是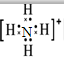 (用电子式表示).
(用电子式表示).
| 微粒 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
 .
.(2)用电子式表示D的形成过程:

(3)比较B与E相应元素的最高价氧化物对应水化物的碱性强弱,为NaOH>Mg(OH)2(用化学式表示).
(4)D与G反应的化学方程式是NH3+H2O═NH3•H2O.
(5)C粒子是
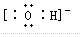 ,F粒子是
,F粒子是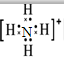 (用电子式表示).
(用电子式表示).
9.某有机物结构简式如图 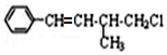 下列叙述不正确的是( )
下列叙述不正确的是( )
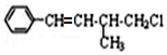 下列叙述不正确的是( )
下列叙述不正确的是( )| A. | 1mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应 | |
| B. | 该有机物分子式为C11H13Cl | |
| C. | 该有机物能通过加成、消去、水解三步反应生成: | |
| D. | 该有机物遇硝酸银溶液不能产生白色沉淀 |
16.黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源.
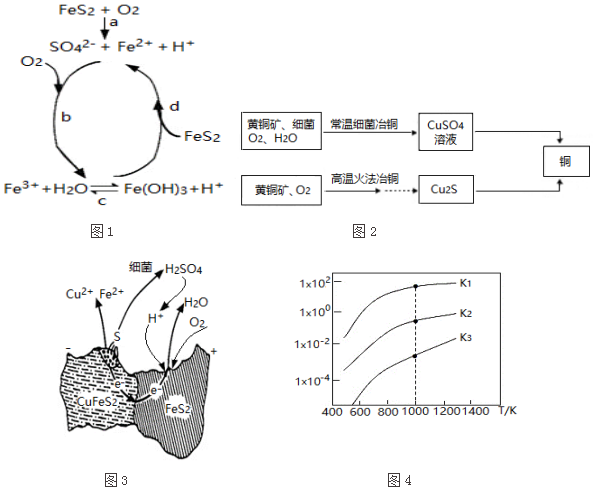
(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示:
①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH增大(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是CuFeS2-4e-=Cu2++Fe2++2S.
②火法冶铜时,由Cu2S制得铜的化学方程式是Cu2S+O2 $\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
①上述反应中,△H1>0(填“>”或“<”).
②提高硫的脱除率可采取的措施有升高温度(举1例).

(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示:
①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH增大(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是CuFeS2-4e-=Cu2++Fe2++2S.
②火法冶铜时,由Cu2S制得铜的化学方程式是Cu2S+O2 $\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
| 相关反应 | 反应热 | 平衡常数 |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
13.在空气中N2所占的体积分数a,质量分数为b,则空气的平均相对分子质量为( )
| A. | 28b/a | B. | 29a/b | C. | ab/28 | D. | 28a/b |
14.下列关于有机化合物的叙述正确的是( )
| A. | 分子式为C3H6Cl2的有机物有4种同分异构体 | |
| B. | 包装用材料聚氯乙烯分子中含有碳碳双键 | |
| C. | 苯与液溴混合后加入铁粉发生了加成反应 | |
| D. | 1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应 |