题目内容
1. 已知酸性高锰酸钾溶液是常用的强氧化剂,可以和草酸钠、二氧化硫等还原性物质发生氧化还原反应.
已知酸性高锰酸钾溶液是常用的强氧化剂,可以和草酸钠、二氧化硫等还原性物质发生氧化还原反应.(1)下列物质能够酸性高锰酸钾溶液褪色的是AD
A.乙炔 B.苯C.己烷 D.己烯
(2)酸性高锰酸钾溶液和草酸钠反应的离子反应式为:MnO4-+C2O42-+H+→CO2↑+Mn2++H2O(未配平)现称取草酸钠(Na2C2O4)样品1.34g溶于稀硫酸中,然后用0.20mol•L-1的高锰酸钾溶液滴定(其中的杂质不跟高锰酸钾和稀硫酸反应),到终点时消耗了15.00mL的高锰酸钾溶液.
①滴定时,将酸性KMnO4标准液装在如图中的甲(填“甲”或“乙”) 滴定管中.
②判断滴定达到终点时的现象是溶液由无色变为紫红色,且在半分钟内不褪色.
③样品中草酸钠的质量分数为75%.
④若滴定终点时俯视滴定管刻度,则由此测得的质量分数会偏小(填“偏大”、“偏小”或“不变”).
(3)请写出酸性高锰酸钾和二氧化硫反应的离子反应方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
分析 (1)具有还原性的物质能使高锰酸钾褪色.
(2)①酸性高锰酸钾具有强氧化性,容易腐蚀橡胶管.
②滴定终点时,溶液由无色变为紫红色,且在半分钟内不褪色.
③先根据高锰酸钾和草酸钠之间的关系式计算草酸钠的物质的量,再根据质量分数公式计算.
④俯视滴定管刻度会使消耗的标准液体积读小.
(3)酸性高锰酸钾具有强氧化性,能氧化二氧化硫生成硫酸,同时自身被还原生成锰离子.
解答 解:(1)乙炔乙烯具有还原性,能使酸性高锰酸钾褪色,故答案为:AD;
(2)①酸性高锰酸钾具有强氧化性,容易腐蚀橡胶管,所以要装在酸式滴定管内,故答案为:甲;
②滴定终点时,溶液由无色变为紫红色,且在半分钟内不褪色,故答案为:溶液由无色变为紫红色,且在半分钟内不褪色;
③根据转移电子相等、原子守恒得该反应方程式为2MnO4-+5C2O4 2-+16H+=10CO2↑+2Mn2++8H2O,
根据草酸钠和高锰酸钾之间的关系式得草酸钠的质量为:$\frac{0.2mol/L×0.015L}{2}×5×134g/mol$=1.005g,质量分数=$\frac{1.005g}{1.34g}$×100%=75%,
故答案为:75%;
④俯视滴定管刻度会使消耗的标准液体积读小,测得的质量分数会偏小,故答案为:偏小;
(3)酸性高锰酸钾具有强氧化性,能氧化二氧化硫生成硫酸,同时自身被还原生成锰离子,由化合价升降总数相等,可知反应为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,故答案为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
点评 本题考查了氧化还原滴定和氧化还原反应,明确元素化合价变化是解本题关键.

练习册系列答案
相关题目
16.电解制金属锰的阳极泥中主要含有MnO2,MnO等.利用该阳极泥生产MnO2的工艺流程如下:
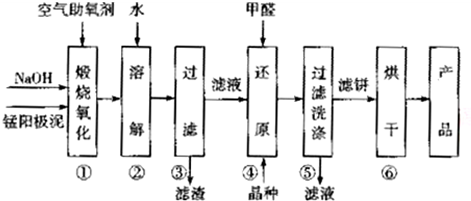
已知:①部分物质的溶解性或Ksp如表:
②Na2MnO4,在pH≤7的环境中,易歧化为MnO2和高锰酸钾.
回答下列问题:
(1)电解MnSO4溶液时,阴极为Mn2+得电子被还原为金属Mn,阳极反应式为2H2O-4e-=O2↑+4H+.
电解过程中溶液的pH不能过高,也不能过低,需要控制电解液的pH≈6.8,原因是pH过高,Mn2+生成Mn(OH)2,pH过低时,阴极上氢离子放电.
(2)步骤①中+2价Mn和+4价Mn均被氧化为Na2MnO4,写出该步骤中+2价Mn反应的化学方程式:MnO+2NaOH+O2$\frac{\underline{\;煅烧\;}}{\;}$Na2MnO4+H2O.
(3)步骤②一④均采用pH≈10的环境,目的是提高产品中Mn的转化率.
(4)步骤④中氧化剂与还原剂的物质的量之比为2:1,则氧化产物的化学式为CO2.该反应中除氧化产物和还原产物的另外一种生成物的化学式为NaOH.
(5)步骤⑥为烘干操作,所用的烘干设备可能是BD(填字母).
A.鼓风机 B.烘干机 C.压榨机 D.红外烘箱
(6)产率与步骤①煅烧温度的关系如图所示:
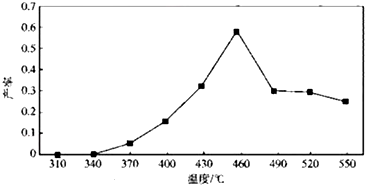
步骤①最好选用的煅烧温度约为B°C(填字母).
A.340 B.460 C.490 D.550.

已知:①部分物质的溶解性或Ksp如表:
| 物质 | MnSO4 | Mn(OH)2 | MnO2 |
| 溶解性或Ksp | 易溶 | 1.9×10-13 | 难溶 |
回答下列问题:
(1)电解MnSO4溶液时,阴极为Mn2+得电子被还原为金属Mn,阳极反应式为2H2O-4e-=O2↑+4H+.
电解过程中溶液的pH不能过高,也不能过低,需要控制电解液的pH≈6.8,原因是pH过高,Mn2+生成Mn(OH)2,pH过低时,阴极上氢离子放电.
(2)步骤①中+2价Mn和+4价Mn均被氧化为Na2MnO4,写出该步骤中+2价Mn反应的化学方程式:MnO+2NaOH+O2$\frac{\underline{\;煅烧\;}}{\;}$Na2MnO4+H2O.
(3)步骤②一④均采用pH≈10的环境,目的是提高产品中Mn的转化率.
(4)步骤④中氧化剂与还原剂的物质的量之比为2:1,则氧化产物的化学式为CO2.该反应中除氧化产物和还原产物的另外一种生成物的化学式为NaOH.
(5)步骤⑥为烘干操作,所用的烘干设备可能是BD(填字母).
A.鼓风机 B.烘干机 C.压榨机 D.红外烘箱
(6)产率与步骤①煅烧温度的关系如图所示:

步骤①最好选用的煅烧温度约为B°C(填字母).
A.340 B.460 C.490 D.550.
6.下列滴定反应中,指示剂使用不正确的是( )
| A. | 用标准FeCl3溶液滴定KI溶液,选择KSCN溶液 | |
| B. | 用I2溶液滴定Na2SO3溶液,淀粉作指示剂 | |
| C. | 用AgNO3溶液滴定NaCl溶液,Na2CrO4作指示剂 | |
| D. | 用H2O2溶液滴定KI溶液,淀粉作指示剂 |
10.环己酮是重要的化工原料,也是重要的工业溶剂.实验室制备环己酮的原理、有关数据及装置示意图如图:
反应原理:如图1所示
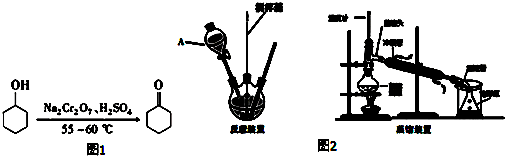
反应放热,温度过高或者重铬酸钠过量会进一步氧化.
主要物料及产物的物理参数:
实验装置:
如图2所示
实验步骤:
Ⅰ.投料:在100mL三颈烧瓶中加入20mL水,慢慢加入5mL浓硫酸摇动,振荡下缓慢加入5mL(4.8g,0.048mol)环己醇,并将混合液温度降至30℃以下.将5g(0.019mol)重铬酸钠溶于水得橙红色溶液备用.
Ⅱ.反应:将约$\frac{1}{5}$的重铬酸钠溶液加入三颈烧瓶中,充分搅拌使之混合均匀.冷水浴冷却,控制反应温度在55~60℃.待橙红色消失后,再将剩余的重铬酸钠溶液分四次加入到三颈烧瓶中.当温度自动下降时,加入4mL甲醇使反应液完全变成墨绿色(三价铬);
Ⅲ.蒸馏:在反应瓶中加入30mL水,并改为蒸馏装置,收集90~99℃之间的馏分(环己酮与水的共沸物)至无油珠为止;
Ⅳ.萃取、干燥:将馏出液用食盐饱和后转入分液漏斗中,分出有机层.水层用8mL乙醚提取一次,将乙醚提取液和有机层合并,用无水硫酸镁干燥; 5.蒸馏,收集环己酮产品2.6g. 请回答下列问题:
(1)装置A的名称是分液漏斗.
(2)完成并配平反应方程式:
3 +1 Na2Cr2O7+4H2SO4→3
+1 Na2Cr2O7+4H2SO4→3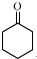 +1 Na2SO4+1 Cr2(SO4)3+7 H2O
+1 Na2SO4+1 Cr2(SO4)3+7 H2O
(3)反应过程中加入甲醇后有无色气体生成.加入甲醇的作用是将过量的重铬酸钠还原,防止环己酮继续被氧化,请用离子方程式表示反应原理CH3OH+Cr2O72-+8H+→CO2↑+2Cr3++6H2O.
(4)步骤4向馏出液加入食盐的目的是利用盐析原理,减少环己酮在水中的溶解度,有利于分层,将乙醚提取液和有机层合并的原因是减少环己酮在水中溶解造成的损失.
(5)计算所得产品的产率55.3%.(保留三位有效数字)
反应原理:如图1所示

反应放热,温度过高或者重铬酸钠过量会进一步氧化.
主要物料及产物的物理参数:
| 名称 | 性状 | 密度 | 溶点℃ | 沸点℃ | 溶解度 | |
| 水 | 乙醚 | |||||
| 环已醇 | 无色,有刺激性气味 | 0.9624 | 25.93 | 161.5 | 5.67g/100mL | ∞ |
| 环已酮 | 无色,有刺激性气味 | 0.9478 | - | 155.7 | 2.4g/100mL | ∞ |
如图2所示
实验步骤:
Ⅰ.投料:在100mL三颈烧瓶中加入20mL水,慢慢加入5mL浓硫酸摇动,振荡下缓慢加入5mL(4.8g,0.048mol)环己醇,并将混合液温度降至30℃以下.将5g(0.019mol)重铬酸钠溶于水得橙红色溶液备用.
Ⅱ.反应:将约$\frac{1}{5}$的重铬酸钠溶液加入三颈烧瓶中,充分搅拌使之混合均匀.冷水浴冷却,控制反应温度在55~60℃.待橙红色消失后,再将剩余的重铬酸钠溶液分四次加入到三颈烧瓶中.当温度自动下降时,加入4mL甲醇使反应液完全变成墨绿色(三价铬);
Ⅲ.蒸馏:在反应瓶中加入30mL水,并改为蒸馏装置,收集90~99℃之间的馏分(环己酮与水的共沸物)至无油珠为止;
Ⅳ.萃取、干燥:将馏出液用食盐饱和后转入分液漏斗中,分出有机层.水层用8mL乙醚提取一次,将乙醚提取液和有机层合并,用无水硫酸镁干燥; 5.蒸馏,收集环己酮产品2.6g. 请回答下列问题:
(1)装置A的名称是分液漏斗.
(2)完成并配平反应方程式:
3
 +1 Na2Cr2O7+4H2SO4→3
+1 Na2Cr2O7+4H2SO4→3 +1 Na2SO4+1 Cr2(SO4)3+7 H2O
+1 Na2SO4+1 Cr2(SO4)3+7 H2O(3)反应过程中加入甲醇后有无色气体生成.加入甲醇的作用是将过量的重铬酸钠还原,防止环己酮继续被氧化,请用离子方程式表示反应原理CH3OH+Cr2O72-+8H+→CO2↑+2Cr3++6H2O.
(4)步骤4向馏出液加入食盐的目的是利用盐析原理,减少环己酮在水中的溶解度,有利于分层,将乙醚提取液和有机层合并的原因是减少环己酮在水中溶解造成的损失.
(5)计算所得产品的产率55.3%.(保留三位有效数字)
 .
. 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.