题目内容
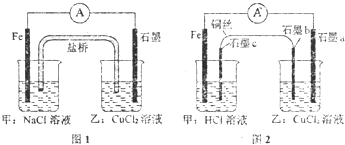 将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )
将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )| A、图1盐桥中的阳离子移向甲装置 | ||||
| B、两图都是将化学能转变成电能的装置 | ||||
C、图2中乙装置总反应的离子方程式:Cu2++2Cl-
| ||||
| D、图2中电子流向为Fe→电流计→石墨a→石墨b→→石墨c→Fe |
考点:原电池和电解池的工作原理
专题:
分析:A.图1铁为原电池负极,阳离子向正极移动;
B.图2甲为原电池,乙为电解池;
C.图2乙装置为电解氯化铜的装置;
D.电子只在导线中移动,不能进入溶液.
B.图2甲为原电池,乙为电解池;
C.图2乙装置为电解氯化铜的装置;
D.电子只在导线中移动,不能进入溶液.
解答:
解:A.图1铁为原电池负极,阳离子向正极移动,应向乙移动,故A错误;
B.图2甲为原电池,乙为电解池,电解池是将电能转化为化学能的装置,故B错误;
C.图2乙装置为电解氯化铜的装置,生成氯气和铜,总反应的离子方程式:Cu2++2Cl-
Cu+Cl2↑,故C正确;
D.电子只在导线中移动,不能进入溶液,则图2中电子流向为:Fe→电流计→石墨a 石墨b→铜丝→石墨c,故D错误.
故选C.
B.图2甲为原电池,乙为电解池,电解池是将电能转化为化学能的装置,故B错误;
C.图2乙装置为电解氯化铜的装置,生成氯气和铜,总反应的离子方程式:Cu2++2Cl-
| ||
D.电子只在导线中移动,不能进入溶液,则图2中电子流向为:Fe→电流计→石墨a 石墨b→铜丝→石墨c,故D错误.
故选C.
点评:本题考查了原电池原理和电解池原理的应用,明确原电池的构成条件以及电极的判断是解题的关键,注意电子不能在溶液中移动,题目难度中等.

练习册系列答案
相关题目
与30mL1mol/L的MgCl2溶液中Cl-浓度相同的是( )
| A、150mL0.2mol/LFeCl2溶液 |
| B、90mL2mol/LNaCl溶液 |
| C、60mL1mol/LAlCl3溶液 |
| D、30mL0.5mol/LCaCl2溶液 |
1.92g铜粉与一定量浓硝酸反应后铜粉完全溶解,得到气体1.12L(标况),则所消耗硝酸的物质的量( )
| A、0.12mol |
| B、0.11mol |
| C、0.99mol |
| D、0.08mol |
下列离子方程式书写正确的是( )
| A、在FeI2溶液中滴入几滴稀溴水:Fe2++Br2=2Fe3++2Br- |
| B、FeCl3溶液中滴加过量Na2S溶液:2Fe3++S2-═2Fe2++S↓ |
| C、在NaHSO3溶液中滴入Ca(OH)2溶液:HSO3-+OH-=SO32-+H2O |
| D、等物质的量浓度、等体积的NaHSO4溶液与Ba(OH)2溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
往NH4HSO4溶液中逐滴加入Ba(OH)2溶液,可能发生的离子方程式正确的是( )
| A、Ba2++SO42-=BaSO4↓ |
| B、NH4++H++2OH-=NH3?H2O+H2O |
| C、NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3?H2O+H2O |
| D、NH4++H++2SO42-+2Ba2++2OH-=2BaSO4↓+NH3?H2O+H2O |
 有X、Y、Z 3种元素,X是有机化合物中必含的元素,Y是地壳里含量最多的元素,Z是质量最轻的元素.X与Y能结合成两种化合物A和B,A可以燃烧,B不可以燃烧,也不支持燃烧;X与Z结合的最简单的化合物C有可燃性;X、Y与Z三种元素结合的化合物D常用做实验室加热的燃料.
有X、Y、Z 3种元素,X是有机化合物中必含的元素,Y是地壳里含量最多的元素,Z是质量最轻的元素.X与Y能结合成两种化合物A和B,A可以燃烧,B不可以燃烧,也不支持燃烧;X与Z结合的最简单的化合物C有可燃性;X、Y与Z三种元素结合的化合物D常用做实验室加热的燃料.
 在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应达到平衡后,测得混合气体为7体积.
在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应达到平衡后,测得混合气体为7体积.