题目内容
与30mL1mol/L的MgCl2溶液中Cl-浓度相同的是( )
| A、150mL0.2mol/LFeCl2溶液 |
| B、90mL2mol/LNaCl溶液 |
| C、60mL1mol/LAlCl3溶液 |
| D、30mL0.5mol/LCaCl2溶液 |
考点:物质的量浓度的相关计算
专题:
分析:电解质离子的浓度=电解质浓度×电解质电离出该离子的数目,与溶液的体积无关,1mol/L的MgCl2溶液中Cl-浓度为2mol/L,据此结合选项判断.
解答:
解:1mol/L的MgCl2溶液中Cl-浓度为2mol/L,
A、150mL 0.2mol/L FeCl2溶液中Cl-浓度为:0.2mol/L×2=0.4mol/L,故A错误;
B、90mL 2mol/L NaCl溶液中Cl-浓度为:2mol/L×1=2mol/L,故B正确;
C、60mL 1mol/LAlCl3溶液中Cl-浓度为:1mol/L×3=3mol/L,故C错误;
D、30mL 0.5mol/L CaCl2溶液中Cl-浓度为:0.5mol/L×2=1mol/L,故D错误;
故选B.
A、150mL 0.2mol/L FeCl2溶液中Cl-浓度为:0.2mol/L×2=0.4mol/L,故A错误;
B、90mL 2mol/L NaCl溶液中Cl-浓度为:2mol/L×1=2mol/L,故B正确;
C、60mL 1mol/LAlCl3溶液中Cl-浓度为:1mol/L×3=3mol/L,故C错误;
D、30mL 0.5mol/L CaCl2溶液中Cl-浓度为:0.5mol/L×2=1mol/L,故D错误;
故选B.
点评:本题考查物质的量浓度的计算,为高频考点,题目难度中等,侧重于学生的分析能力的考查,比较基础,注意电解质溶液中离子的浓度与电解质浓度的计算

练习册系列答案
相关题目
雌黄(As2S3)是提取砷的主要矿物原料,雌黄和HNO3能发生如下反应:As2S3+10H++10NO
═2H3AsO4+3S+10NO2↑+2H2O.下列说法正确的是( )
- 3 |
| A、上述反应中As2S3发生还原反应,作还原剂 |
| B、该反应的氧化产物为H3AsO4和S |
| C、该反应可以说明HNO3的酸性强于H3AsO4的酸性 |
| D、若生成2mol H3AsO4,则反应中转移电子的物质的量为4 mol |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
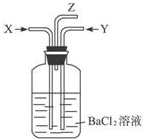
①洗气瓶中产生的沉淀是碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现.

①洗气瓶中产生的沉淀是碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现.
| A、①④ | B、①② | C、②③ | D、③④ |
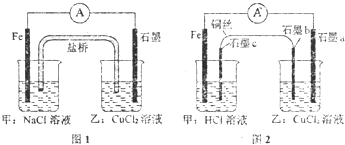 将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )
将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )| A、图1盐桥中的阳离子移向甲装置 | ||||
| B、两图都是将化学能转变成电能的装置 | ||||
C、图2中乙装置总反应的离子方程式:Cu2++2Cl-
| ||||
| D、图2中电子流向为Fe→电流计→石墨a→石墨b→→石墨c→Fe |
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将20样品加热,其质量变为13.8g,则该样品的纯度(质量分数)是( )
| A、84% | B、16% |
| C、69% | D、31% |
下列有关化学用语使用正确的是( )
A、N2的电子式: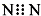 | ||
B、中子数为18的氯原子结构示意图: | ||
C、质子数为53,中子数为78的碘原子:
| ||
| D、NaHCO3在水溶液中的电离方程式:NaHCO3 ═Na++H++CO32- |
下列离子方程式书写正确的是( )
A、用电极电解少量的MgCl2溶液:2H2O+2Cl-
| ||||
| B、向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | ||||
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | ||||
| D、用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |

 已知A是一种只含碳、氢、氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍.A可以和金属钠反应放出氢气并在一定条件下发生如图所示的变化.回答下列问题:
已知A是一种只含碳、氢、氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍.A可以和金属钠反应放出氢气并在一定条件下发生如图所示的变化.回答下列问题: