题目内容
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.

请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀.
①A中含有的金属元素为;A在元素周期律表中的位置为 .
②该金属元素的单质与某氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为 .
(2)若A为固态非金属单质,A与X同周期,同时A在X中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构.
①B的电子式为 .
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为 .
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物.
①A中所含有的化学键是 .
②将4.48L(标准状况下)X通入100mL3mol/LA的水溶液后,溶液中离子浓度由大到小的顺序为 .
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol/L.若取相同质量的固体加热至恒重,剩余固体的质量为 .

请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀.
①A中含有的金属元素为;A在元素周期律表中的位置为
②该金属元素的单质与某氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为
(2)若A为固态非金属单质,A与X同周期,同时A在X中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构.
①B的电子式为
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物.
①A中所含有的化学键是
②将4.48L(标准状况下)X通入100mL3mol/LA的水溶液后,溶液中离子浓度由大到小的顺序为
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol/L.若取相同质量的固体加热至恒重,剩余固体的质量为
考点:无机物的推断
专题:
分析:A、B、C、X是中学化学常见物质,均由短周期元素组成.
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠;
①A中含有的金属元素为Al;
②该金属元素的单质与某氧化物在高温下反应,常用于焊接铁轨及定向爆破,为氧化铁和铝的反应;
(2)①若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构,同时A在X中燃烧,由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,x为氯气;三氯化磷是共价化合物,写出电子式;
②C与水剧烈反应,生成两种常见酸,生成盐酸和磷酸;
(3)若A、B、C的焰色反应均呈黄色,含有钠元素,水溶液均为碱性,X为气态酸性氧化物,结合转化关系可知A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳,以此解答该题.
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠;
①A中含有的金属元素为Al;
②该金属元素的单质与某氧化物在高温下反应,常用于焊接铁轨及定向爆破,为氧化铁和铝的反应;
(2)①若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构,同时A在X中燃烧,由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,x为氯气;三氯化磷是共价化合物,写出电子式;
②C与水剧烈反应,生成两种常见酸,生成盐酸和磷酸;
(3)若A、B、C的焰色反应均呈黄色,含有钠元素,水溶液均为碱性,X为气态酸性氧化物,结合转化关系可知A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳,以此解答该题.
解答:
解:A、B、C、X是中学化学常见物质,均由短周期元素组成.
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠;
①A中含有的金属元素为Al,在周期表中位置是第三周期、ⅢA族,故答案为:第三周期、ⅢA族;
②Al与氧化铁发生铝热反应可用于焊接铁轨及定向爆破,此反应的化学方程式为2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe;
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构,同时A在X中燃烧,由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,x为氯气,
①B为三氯化磷,各原子都大8电子稳定结构,三氯化磷B的电子式为 ,
,
故答案为: ;
;
②C为五氯化磷,与水剧烈反应,生成磷酸和盐酸,反应的化学方程式为PCl5+4H2O=H3PO4+5HC1.
故答案为:PCl5+4H2O=H3PO4+5HC1;
(3)若A、B、C的焰色反应均呈黄色,含有钠元素,水溶液均为碱性,X为气态酸性氧化物,结合转化关系可知A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳,
①A为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,属于A中所含有的化学键是 离子键、共价键.
故答案为:离子键、共价键;
②n (CO2)=0.2mol,n(NaOH)=0.3mol,
则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,
则有:2>
=
>1,
所以:所得产物为Na2CO3和NaHCO3,
设所得产物中含Na2CO3为xmol,NaHCO3为ymol,
则得方程组:
解得:x=0.1,y=0.1,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,c(Na+)最大,碳酸根离子水解大于碳酸氢根离子的水解,则c(HCO3-)>c(CO32-),
水解使溶液显碱性,则c(OH-)>c(H+),显性离子大于隐性离子,所以c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
即离子浓度大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为
×0.1L×0.5mol/L×106g/mol=2.65g.
故答案为:2.65g.
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠;
①A中含有的金属元素为Al,在周期表中位置是第三周期、ⅢA族,故答案为:第三周期、ⅢA族;
②Al与氧化铁发生铝热反应可用于焊接铁轨及定向爆破,此反应的化学方程式为2Al+Fe2O3
| ||
| ||
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构,同时A在X中燃烧,由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,x为氯气,
①B为三氯化磷,各原子都大8电子稳定结构,三氯化磷B的电子式为
 ,
,故答案为:
 ;
;②C为五氯化磷,与水剧烈反应,生成磷酸和盐酸,反应的化学方程式为PCl5+4H2O=H3PO4+5HC1.
故答案为:PCl5+4H2O=H3PO4+5HC1;
(3)若A、B、C的焰色反应均呈黄色,含有钠元素,水溶液均为碱性,X为气态酸性氧化物,结合转化关系可知A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳,
①A为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,属于A中所含有的化学键是 离子键、共价键.
故答案为:离子键、共价键;
②n (CO2)=0.2mol,n(NaOH)=0.3mol,
则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,
则有:2>
| n(NaOH) |
| n(CO2) |
| 3 |
| 2 |
所以:所得产物为Na2CO3和NaHCO3,
设所得产物中含Na2CO3为xmol,NaHCO3为ymol,
则得方程组:
|
解得:x=0.1,y=0.1,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,c(Na+)最大,碳酸根离子水解大于碳酸氢根离子的水解,则c(HCO3-)>c(CO32-),
水解使溶液显碱性,则c(OH-)>c(H+),显性离子大于隐性离子,所以c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
即离子浓度大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为
| 1 |
| 2 |
故答案为:2.65g.
点评:本题考查了无机物推断,为高频考点,侧重于学生的分析能力和计算能力的考查,同时考查学生灵活运用知识解答问题的能力,根据物质的特殊现象再结合物质之间的转化关系来分析解答,题目难度中等.

练习册系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓ |
| B、向苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| C、Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| D、石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O |
雌黄(As2S3)是提取砷的主要矿物原料,雌黄和HNO3能发生如下反应:As2S3+10H++10NO
═2H3AsO4+3S+10NO2↑+2H2O.下列说法正确的是( )
- 3 |
| A、上述反应中As2S3发生还原反应,作还原剂 |
| B、该反应的氧化产物为H3AsO4和S |
| C、该反应可以说明HNO3的酸性强于H3AsO4的酸性 |
| D、若生成2mol H3AsO4,则反应中转移电子的物质的量为4 mol |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
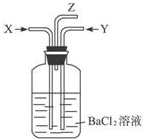
①洗气瓶中产生的沉淀是碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现.

①洗气瓶中产生的沉淀是碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现.
| A、①④ | B、①② | C、②③ | D、③④ |
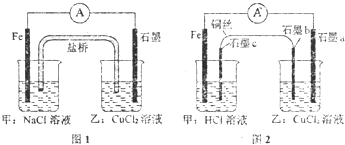 将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )
将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )| A、图1盐桥中的阳离子移向甲装置 | ||||
| B、两图都是将化学能转变成电能的装置 | ||||
C、图2中乙装置总反应的离子方程式:Cu2++2Cl-
| ||||
| D、图2中电子流向为Fe→电流计→石墨a→石墨b→→石墨c→Fe |
下列有关化学用语使用正确的是( )
A、N2的电子式: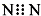 | ||
B、中子数为18的氯原子结构示意图: | ||
C、质子数为53,中子数为78的碘原子:
| ||
| D、NaHCO3在水溶液中的电离方程式:NaHCO3 ═Na++H++CO32- |
某密闭容器中充入等物质的量的A和B,一定温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率随时间的变化如图所示:下列说法中正确的是( )


| A、前8minA的平均反应速率为0.08mol?L-1min-1 |
| B、反应方程式中的x=1,正反应为吸热反应 |
| C、30min时降低温度,40min时升高温度 |
| D、30-40min之间该反应增大了压强或使用了催化剂 |
