题目内容
1.92g铜粉与一定量浓硝酸反应后铜粉完全溶解,得到气体1.12L(标况),则所消耗硝酸的物质的量( )
| A、0.12mol |
| B、0.11mol |
| C、0.99mol |
| D、0.08mol |
考点:化学方程式的有关计算
专题:
分析:反应生成Cu(NO3)2与氮的氧化物(NO、NO2中的一种或2种),反应中硝酸起氧化剂与酸性作用,起氧化剂作用的酸性生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,根据氮原子守恒可知n反应(HNO3)=2Cu(NO3)2+n(NO,NO2),根据n=
计算1.92gCu的物质的量,由Cu原子守恒可知n(Cu)=Cu(NO3)2,根据n=
计算生成气体物质的量,据此计算解答.
| m |
| M |
| V |
| Vm |
解答:
解:1.92gCu的物质的量=
=0.03mol,
n(NO,NO2)=
=0.05mol,
反应生成Cu(NO3)2与氮的氧化物(NO、NO2中的一种或2种),反应中硝酸起氧化剂与酸性作用,起氧化剂作用的酸性生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,由Cu原子守恒可知n(Cu)=Cu(NO3)2=0.03mol,
根据氮原子守恒可知n反应(HNO3)=2Cu(NO3)2+n(NO,NO2)=2×0.03mol+0.05mol=0.11mol,
故选B.
| 1.92g |
| 64g/mol |
n(NO,NO2)=
| 1.12L |
| 22.4L/mol |
反应生成Cu(NO3)2与氮的氧化物(NO、NO2中的一种或2种),反应中硝酸起氧化剂与酸性作用,起氧化剂作用的酸性生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,由Cu原子守恒可知n(Cu)=Cu(NO3)2=0.03mol,
根据氮原子守恒可知n反应(HNO3)=2Cu(NO3)2+n(NO,NO2)=2×0.03mol+0.05mol=0.11mol,
故选B.
点评:本题考查化学方程式计算、硝酸性质等,题目可以根据Cu与生成气体的体积判断发生的反应,再利用方程式计算,但比较复杂,注意分析硝酸的作用,运用原子守恒解答,题目设计有利于考查学生的综合能力,难度中等.

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
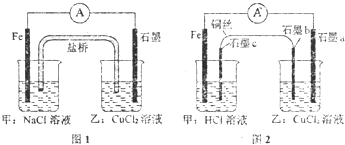 将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )
将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )| A、图1盐桥中的阳离子移向甲装置 | ||||
| B、两图都是将化学能转变成电能的装置 | ||||
C、图2中乙装置总反应的离子方程式:Cu2++2Cl-
| ||||
| D、图2中电子流向为Fe→电流计→石墨a→石墨b→→石墨c→Fe |
下列有关化学用语使用正确的是( )
A、N2的电子式: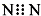 | ||
B、中子数为18的氯原子结构示意图: | ||
C、质子数为53,中子数为78的碘原子:
| ||
| D、NaHCO3在水溶液中的电离方程式:NaHCO3 ═Na++H++CO32- |
将10mL 5mol/L的HCl溶液稀释到200mL,从中取出5mL,这5mL溶液的物质的量浓度为( )
| A、0.5mo/L |
| B、0.25mol/L |
| C、0.1mol/L |
| D、1mol/L |
下列物质中,属于电解质的是( )
| A、CO2 |
| B、Cu |
| C、NaCl |
| D、酒精 |

 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表: