题目内容
5.下列关于有机物说法正确的是( )| A. | 米酒变酸的过程涉及了氧化反应 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 含5个碳原子的有机物分子中最多可形成4个碳碳单键 | |
| D. | 蛋白质的水解和油脂的皂化都是由高分子生成小分子的过程 |
分析 A.乙醇被氧化生成乙酸;
B.植物油为酯类物质;
C.如为环状化合物,可形成5个碳碳键;
D.油脂不是高分子化合物.
解答 解:A.米酒变酸的过程涉及乙醇被氧化生成乙酸,为氧化反应,故A正确;
B.植物油为酯类物质,含有氧元素,属于烃的衍生物,故B错误;
C.如为环状化合物,可形成5个碳碳键,故C错误;
D.高分子化合物的相对分子质量在10000以上,油脂不是分子化合物,故D错误.
故选A.
点评 本题考查较为综合,涉及有机物的组成、结构、性质以及应用,为高考常见题型和高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列叙述正确的是( )
| A. | 加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- | |
| B. | 鉴别碳酸钠溶液和碳酸氢钠溶液,可以用稀CaCl2 溶液 | |
| C. | 做焰色反应时,每次实验要将铂丝用水洗干净,再蘸取其他物质在灯焰上灼烧 | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- |
13.下列关于反应能量的说法正确的是( )
| A. | 若反应A(s)=B(s);△H<O,则说明A物质比B物质稳定 | |
| B. | Zn(s)+CuSO4 (aq)═ZnSO4 (aq)+Cu(s);△H=-216kJ•mol-1.则反应物总能量<生成物总能量 | |
| C. | 101kPa时,2H2(g)+O2(g)═2H2O(l);△H=-QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-l | |
| D. | H+(aq)+OH- (aq)=H2O(l);△H=-57.3 kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
20.二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
I、(1)合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,既要加快反应速率又要提高H2的转化率,可以采取的措施是D.
A、低温 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)保持其它条件不变,只改变下列条件能使H2的体积分数增大的是C.
A.使用高效催化剂 B.增大压强
C.升高温度 D.向容器中再充入1mol (CH3OCH3)和1molCO2
(3)在一定温度下,可以判断该分解反应已经达到化学平衡的是ABD.
A.V正(CO)﹕V逆(CO2)=3﹕1B.恒容密闭容器中总压强不变
C.恒容密闭容器中混合气体的密度不变D.密闭容器中氢气的体积分数不变
(4)合成二甲醚反应二:2CH3OH(g)?CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
403K时,该反应的平衡常数为400
Ⅱ、二甲醚燃料电池的工作原理如图一所示.
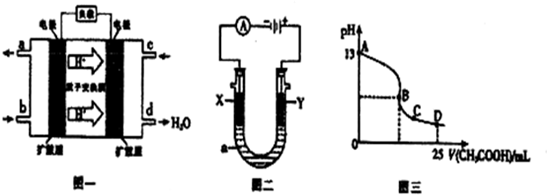
(1)该电池负极的电极反应式为CH3OCH3+3H2O-12e-=12H++2CO2.
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,两极共产生0.224L(标准状况下)气体时,溶液的pH为12.(忽略溶液的体积变化)
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在AB区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是c(CH3COO-)>c(K+)>c(H+)>c(OH-).
I、(1)合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,既要加快反应速率又要提高H2的转化率,可以采取的措施是D.
A、低温 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)保持其它条件不变,只改变下列条件能使H2的体积分数增大的是C.
A.使用高效催化剂 B.增大压强
C.升高温度 D.向容器中再充入1mol (CH3OCH3)和1molCO2
(3)在一定温度下,可以判断该分解反应已经达到化学平衡的是ABD.
A.V正(CO)﹕V逆(CO2)=3﹕1B.恒容密闭容器中总压强不变
C.恒容密闭容器中混合气体的密度不变D.密闭容器中氢气的体积分数不变
(4)合成二甲醚反应二:2CH3OH(g)?CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH3OH | CH3OCH3 | H2O | ||
| l | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
Ⅱ、二甲醚燃料电池的工作原理如图一所示.

(1)该电池负极的电极反应式为CH3OCH3+3H2O-12e-=12H++2CO2.
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,两极共产生0.224L(标准状况下)气体时,溶液的pH为12.(忽略溶液的体积变化)
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在AB区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是c(CH3COO-)>c(K+)>c(H+)>c(OH-).
10.海水开发利用的部分过程如图所示.下列说法错误的是( )

| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 富集溴一般先用空气和水蒸气吹出单质溴,在用SO2将其还原吸收 | |
| D. | 工业生产中常选用NaOH作为沉淀剂 |
17.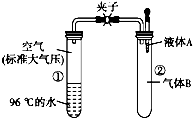 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 饱和食盐水、氯化氢 | ||
| C. | 氢氧化钠溶液、一氧化碳 | D. | 石灰水、二氧化硫 |
15.我国规定饮用水质量标准必须符合下列要求:
以下是源水处理成自来水的工艺流程示意图:
源水→曝气池$\stackrel{加石灰}{→}$一级沉降池$→_{通入CO_{2}}^{凝聚剂井}$二级沉降池$\stackrel{气体A}{→}$过滤池→自来水
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式Mg2++OH-=Mg(OH)2↓.
(2)凝聚剂除去悬浮固体颗粒的过程③(填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3沉淀.
(3)通入二氧化碳的目的是将Ca2+除去和调整溶液中的pH达到饮用水质量标准.
(4)气体A的作用是杀菌消毒.这种作用是基于气体A和水反应的产物具有强氧化性.
(5)下列物质中,①和③可以作为气体A的代用品.(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
| pH | 6.5~6.8 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/L |
源水→曝气池$\stackrel{加石灰}{→}$一级沉降池$→_{通入CO_{2}}^{凝聚剂井}$二级沉降池$\stackrel{气体A}{→}$过滤池→自来水
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式Mg2++OH-=Mg(OH)2↓.
(2)凝聚剂除去悬浮固体颗粒的过程③(填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3沉淀.
(3)通入二氧化碳的目的是将Ca2+除去和调整溶液中的pH达到饮用水质量标准.
(4)气体A的作用是杀菌消毒.这种作用是基于气体A和水反应的产物具有强氧化性.
(5)下列物质中,①和③可以作为气体A的代用品.(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.