题目内容
2.下列说法正确的是( )| A. | 将标准状况下的2.24L CO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| B. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| C. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| D. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c (OH-)>c (H+)+c(HA) |
分析 A.将标准状况下的2.24L CO2通入150mL 1mol•L-1 NaOH溶液中,得到等物质的量的Na2CO3、NaHCO3;
B.①铝离子水解抑制铵根离子的水解;②铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解;
C.溶液显碱性,HB-的水解程度大于电离程度;
D.反应后溶质为等浓度的NaA和HA,测得混合液pH=5,说明HA的电离程度大于NaA的水解程度,则c(A-)>c(HA),根据物料守恒c(A-)+c(HA)=2c(Na+)可得:c(HA)<c(Na+),再结合电荷守恒进行判断.
解答 解:A.将标准状况下的2.24L CO2通入150mL 1mol•L-1 NaOH溶液中,得到等物质的量的Na2CO3、NaHCO3,HCO3-水解程度大于其电离程度,CO32-的水解程度大于HCO3-的水解程度,故c(HCO3-)>c(CO32-),故A错误;
B.同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl③NH3•H2O,④CH3COONH4,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解,则c(NH4+)由大到小的顺序是:①>②>④>③,故B错误;
C.溶液显碱性,HB-的水解程度大于电离程度,HB-水解生成H2B,HB-电离生成B2-,所以溶液中c(HB-)>c(H2B)>c(B2-),故C错误;
D.室温下将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化),溶质为等浓度的NaA和HA,测得混合液pH=5,说明HA的电离程度大于NaA的水解程度,则c(A-)>c(HA),根据物料守恒c(A-)+c(HA)=2c(Na+)可得:c(HA)<c(Na+),结合电荷守恒c(A-)+c (OH-)=c(H+)+c(Na+)可得:c(A-)+c (OH-)>c(H+)+c(HA),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握盐的水解原理、电荷守恒、物料守恒等知识在判断离子浓度大小中的应用方法,试题培养了学生得到分析能力及灵活应用能力.

| A. | 溶液中Cu2+与Fe2+的物质的量比为1:2 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 氧化性:Zn2+>Cu2+>Fe3+>Ag+ | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
| A. | 若反应A(s)=B(s);△H<O,则说明A物质比B物质稳定 | |
| B. | Zn(s)+CuSO4 (aq)═ZnSO4 (aq)+Cu(s);△H=-216kJ•mol-1.则反应物总能量<生成物总能量 | |
| C. | 101kPa时,2H2(g)+O2(g)═2H2O(l);△H=-QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-l | |
| D. | H+(aq)+OH- (aq)=H2O(l);△H=-57.3 kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
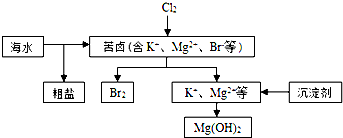
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 富集溴一般先用空气和水蒸气吹出单质溴,在用SO2将其还原吸收 | |
| D. | 工业生产中常选用NaOH作为沉淀剂 |
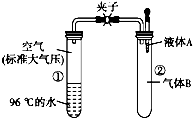 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 饱和食盐水、氯化氢 | ||
| C. | 氢氧化钠溶液、一氧化碳 | D. | 石灰水、二氧化硫 |
| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓ |
| A. | 将少量的两种白色固体分别加入1 mol/L的盐酸中,看有无气泡产生 | |
| B. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| C. | 分别取样配成溶液,滴加BaCl2溶液,观察有无白色沉淀 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
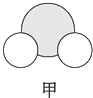 | 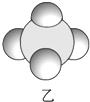 |  |
| 是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
(1)甲、乙、丙中含有的共同元素是氢(填名称).
(2)B元素在周期表中的位置为第2周期ⅣA族.
(3)上述元素的原子M层有一个未成对p电子的是Cl(填元素符号).
(4)丙的电子式为
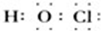 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl. 