题目内容
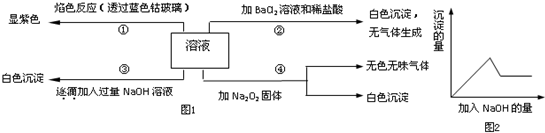
11.某无色溶液中只可能溶有K+、NH4+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子.为分析其组成,现进行如下实验:①取l0mL该溶液于试管中滴加足量的Ba(N03)2溶液,加稀硝酸酸化后过滤得到0.03mol
白色沉淀甲.
②取上述反应后的滤液,加人AgN03溶液未见沉淀产生.
③另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断正确的是( )
| A. | 肯定有Na+、Al3+、Mg2+、SO42- | B. | 肯定有Na+、Mg2+、Al3+、Cl- | ||
| C. | 肯定没有Mg2+、HCO3-、MnO4-、Cl- | D. | 肯定没有K+、NH4+、Cl- |
分析 溶液无色,说明不含MnO4-;
①取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,说明甲为BaSO4,原溶液中含有SO42-;
②向滤液中加入AgNO3溶液未见沉淀产生,说明不含有Cl-、I-;
③因为能与碱共热生成气体的只有NH4+,氢氧化镁不溶于氢氧化钠溶液,Al3+能与氢氧化钠溶液反应生成沉淀又能完全溶解,铝离子与碳酸氢根离子能发生双水解反应而不能大量共存,故不含HCO3-;根据氢氧化铝沉淀0.01mol和标况下氨气为0.224L,利用元素守恒可知有NH4+0.01mol,Al3+为0.01mol,再根据电荷守恒可推知含有K+;则一定含有的离子为K+、NH4+、Al3+、SO42-,一定不含有的离子为MnO4-、Mg2+、Cl-、I-、HCO3-.
解答 解:溶液无色,说明不含MnO4-;
①取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,说明甲为BaSO4,原溶液中含有SO42-;
②向滤液中加入AgNO3溶液未见沉淀产生,说明不含有Cl-、I-;
③因为能与碱共热生成气体的只有NH4+,氢氧化镁不溶于氢氧化钠溶液,Al3+能与氢氧化钠溶液反应生成沉淀又能完全溶解,铝离子与碳酸氢根离子能发生双水解反应而不能大量共存,故不含HCO3-;根据氢氧化铝沉淀0.01mol和标况下氨气为0.224L,利用元素守恒可知有NH4+0.01mol,Al3+为0.01mol,再根据电荷守恒可推知含有K+、;综上所述可知一定含有的离子为K+、NH4+、Al3+、SO42-,一定不含有的离子为MnO4-、Mg2+、Cl-、I-、HCO3-.
A.由上述分析可知,一定不含镁离子,故A错误;
B.由上述分析可知,一定含有的离子为K+、NH4+、Al3+、SO42-,故B错误;
C.肯定没有Mg2+、HCO3-、MnO4-、Cl-,故C正确;
D.由电荷守恒可知,一定含K+,故D错误;
故选C.
点评 本题考查物质检验的实验方案的设计,为高频考点,把握实验中现象与结论的关系、发生的离子反应为解答的关键,注意电荷守恒的应用,题目难度中等.

 智能训练练测考系列答案
智能训练练测考系列答案| A. | SO3 | B. | FeCl2 | C. | Na2O2 | D. | NH3 |
| A. | 0.1 mol溴苯中含有双键的数目为0.3NA | |
| B. | 1L 0.1 mol/L醋酸溶液中含有醋酸分子的数目为0.1 NA | |
| C. | 常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| D. | 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA |
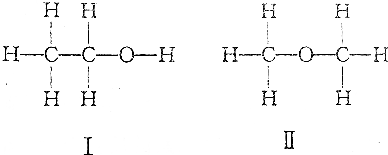
| A. | Ⅰ和Ⅱ是同分异构体 | B. | Ⅰ和Ⅱ物理性质有所不同 | ||
| C. | Ⅰ和Ⅱ化学性质相同 | D. | Ⅰ和Ⅱ含12C的质量分数相同 |
 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++CO2↑+8H2O.
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++CO2↑+8H2O.(1)该滴定实验所需的玻璃仪器有ADE.
A.酸式滴定管(50mL) B.碱式滴定管(50mL)
C.量筒(50mL) D.锥形瓶 E.烧杯
(2)不用碱(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液.试分析原因酸性KMnO4溶液会腐蚀碱式滴定管下端胶管.
(3)滴定终点的现象为当滴入最后一滴标准液时,溶液从无色变成紫红色,且半分钟内保持不变色.
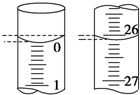
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为0.00mL,终点读数为26.10mL.
(5)某学生根据3次实验分别记录有关数据如表:
| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 2 8.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(6)下列操作中可能使测定结果偏低的是CD(填字母).
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数.

已知:
| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 801 |
(1)高温反应前,常在800℃焙烧铝土矿,使固体中水分挥发、气孔数目增多,其作用是防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率(只要求写出一种)
(2)高温反应后,铝土矿中的氧化物均转变为相应的氯化物,由Al2O3、C和Cl2反应生成AlCl3的化学方程式为Al2O3+3C+3Cl2$\frac{\underline{\;高温\;}}{\;}$2AlCl3+3CO.
(3)气体Ⅱ的主要成分除了Cl2外,还含有CO2、O2、SiCl4.气体Ⅱ常用过量冷的NaOH溶液吸收,吸收液中含有的阴离子主要有CO32-、HCO3-、Cl-、ClO-、SiO32-、OH-.
(4)工业上为了降低生产成本,生产过程中需要控制加入铝粉的量,“废渣”的主要成分是NaCl、FeCl2.
(5)AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,其它离子不参与电极反应,电镀时阴极的电极反应式为4Al2Cl7-+3e-=7AlCl4-+Al.
 .
.