题目内容
16.氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质.(1)写出N2H62+与NaOH溶液反应的离子方程式N2H62++2OH-=N2H4+2H2O.
(2)NH2-的电子式为
 .
.(3)N3-有22个电子.
(4)写出N3-等电子体物质的化学式CO2.(一种)
(5)互为等电子体的微粒往往具有相似的结构,试预测N3-的构型直线型.
分析 (1)中N2H62+中N的化合价为+4价,N2H62+是由中性分子 N2H4 结合2个质子形成的,相当于故N2H62+相当于二元酸,碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O;
(2)NH2-的电子式为: ;
;
(3)1个N含有7个电子,故N3-有22个电子;
(4)含有22个电子的多原子物质有N2O、CO2、CNO-、BeF2、CaH2、C3H4等;
(5)CO2为直线型分子,故可认为N3-的构型为直线型.
解答 解:(1)中N2H62+中N的化合价为+4价,N2H62+是由中性分子N2H4结合2个质子形成的,故N2H62+相当于二元酸,故在碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O,故答案为:N2H62++2OH-=N2H4+2H2O;
(2)NH2-的电子式为: ,故答案为:
,故答案为: ;
;
(3)1个N含有7个电子,故N3-有22个电子,故答案为:22;
(4)含有22个电子的多原子物质有N2O、CO2、CNO-、BeF2、CaH2、C3H4等,故答案为:CO2;
(5)CO2为直线型分子,故可认为N3-的构型为直线型,故答案为:直线型.
点评 本题重点考查了电子式的书写以及等电子微粒的性质,侧重原子结构与分子构型的分析,注意把握原子的电子排布,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
13.黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源.
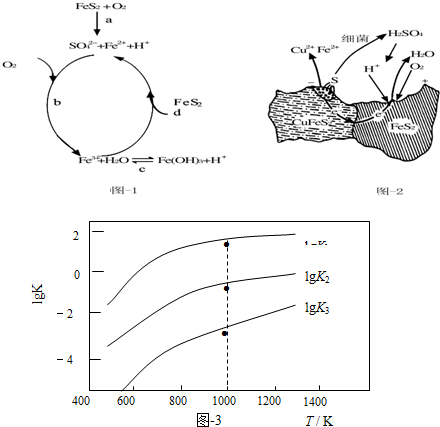
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图-1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图-2
①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图-3.
①上述反应中,△H1>0(选填:“>”或“<”).
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.

(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图-1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图-2
①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图-3.
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.
11.某无色溶液中只可能溶有K+、NH4+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子.为分析其组成,现进行如下实验:
①取l0mL该溶液于试管中滴加足量的Ba(N03)2溶液,加稀硝酸酸化后过滤得到0.03mol
白色沉淀甲.
②取上述反应后的滤液,加人AgN03溶液未见沉淀产生.
③另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断正确的是( )
①取l0mL该溶液于试管中滴加足量的Ba(N03)2溶液,加稀硝酸酸化后过滤得到0.03mol
白色沉淀甲.
②取上述反应后的滤液,加人AgN03溶液未见沉淀产生.
③另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断正确的是( )
| A. | 肯定有Na+、Al3+、Mg2+、SO42- | B. | 肯定有Na+、Mg2+、Al3+、Cl- | ||
| C. | 肯定没有Mg2+、HCO3-、MnO4-、Cl- | D. | 肯定没有K+、NH4+、Cl- |
1.甲、乙两同学在学习了铁的性质后.分别用如下装置进行“Fe粉与水蒸气的反应产物”的实验.

(1)甲同学用图1所示装置进行实验,写出铁粉与H2O蒸气反应的化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,简述证明实验中有氢气产生的实验操作及现象:有大量肥皂泡生成,部分肥皂泡浮在空中,点燃肥皂泡发生轻微爆炸;
(2)乙同学用图2所示装置进行实验.试管a的作用是提供水蒸气;为探究实验结柬后试管内固体物质的成分,乙同学进行了下列实验:
简述步骤Ⅰ中发生反应的离子方程式:Fe3O4+8H+═Fe2++2Fe3++4H2O,Fe+2H+═Fe2++H2↑,简述步骤Ⅱ中“溶液没有出现红色”的原因溶液中三价铁离子可能被过量铁还原为亚铁离子(2Fe3++Fe=3Fe2+).

(1)甲同学用图1所示装置进行实验,写出铁粉与H2O蒸气反应的化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,简述证明实验中有氢气产生的实验操作及现象:有大量肥皂泡生成,部分肥皂泡浮在空中,点燃肥皂泡发生轻微爆炸;
(2)乙同学用图2所示装置进行实验.试管a的作用是提供水蒸气;为探究实验结柬后试管内固体物质的成分,乙同学进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到的黑色固体X,取出少量放人另一试管中,加人少量盐酸,微热 | 黑色粉末逐渐溶解,产生少量气泡 |
| Ⅱ | 向上述实验得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液未出现红色 |
5.锂元素被誉为“能源元素”.锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用.
Ⅰ锂的原子结构示意图为 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
Ⅱ下面是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.
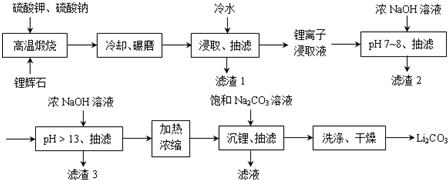
①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4=K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4=Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
④Li2SO4、Li2CO3在不同温度下的溶解度(g/100g水)
(1)浸取时使用冷水的原因是Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率.
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+ 浓度和溶液温度,使得Li2CO3容易析出.
(5)洗涤Li2CO3晶体使用热水.
Ⅰ锂的原子结构示意图为
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.Ⅱ下面是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.

①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4=K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4=Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+ 浓度和溶液温度,使得Li2CO3容易析出.
(5)洗涤Li2CO3晶体使用热水.
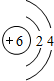 ,C、D、E中原子半径最大的为Na.
,C、D、E中原子半径最大的为Na.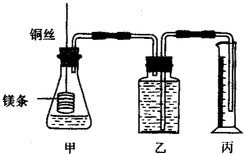 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:


