题目内容
1.士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠粉末,使用时加入水与其中的镁反应放出热量.下面是在室温下对该产品的两个探究实验:【实验I】向加有等量水的三个相同隔热容器中分别加入下列各组物质,结果参见图l.
①1.0mol镁条、0.10mol铁粉、0.10mol氯化钠粉末;
②将1.0mol镁条剪成100份、0.10mol铁粉、0.10mol氯化钠粉末;
③1.0mol镁粉、0.10mol铁粉、0.10mol氯化钠粉末.
【实验2】向加有100mL水的多个相同隔热容器中分别加入由0.10mol镁粉、0.50mol铁粉及不同量的氯化钠粉末组成的混合物,不断搅拌,第15min时记录温度升高的幅度,参见图2.

请回答下列问题:
(1)实验l证实了该反应的反应速率与镁的表面积有关.
(2)实验2中当NaCl的用量大于0.125mol时,实验就无须再做的原因是B(填字母).
A.需要加入更多的铁粉来提高温度 B.已达到沸点不再有温度变化
C.加入NaCl反而会降低反应速率 D.加入更多的NaCl不再增加反应速率
(3)如果在实验2中加入了0.060mol的NaCl,则第15min时混合物的温度最接近于A(填字母).
A.62℃B.50℃C.42℃D.34℃
(4)铁粉、NaCl能使反应速率加快的原因是镁粉、铁粉与NaCl的水溶液构成了原电池,加快了反应速率.
分析 (1)根据实验1中三组物质不同之处判断实验目的;
(2)结合图2可知,NaCl用量达到0.125 mol时,溶液达到沸腾状态,再增加NaCl的用量时,温度不再发生变化;
(3)根据图2当加入0.06 mol NaCl时记录的温度进行判断;
(4)根据镁粉、铁粉与NaCl水溶液共同构成了原电池的角度进行分析.
解答 解:(1)实验1中三组物质不同之处在于镁的状态,故实验1是研究的是镁的表面积与速率的关系,
故答案为:镁的表面积;
(2)根据图2可知,NaCl用量达到0.125 mol时,溶液已经达到沸腾状态,当NaCl的用量再增加时,温度不再发生变化,所以无需再做,所以B正确,
故答案为:B;
(3)由图2可见,当加入0.06 mol NaCl时,第15 min记录的温度升高值在42℃左右,所以则第15min时混合物的温度最接近于:42℃+20℃=62℃,则A正确,
故答案为:A;
(4)镁粉、铁粉与NaCl水溶液共同构成了原电池,大大促进了Mg的反应,加快了反应的速率,
故答案为:镁粉、铁粉与NaCl的水溶液构成了原电池,加快了反应速率.
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,注意掌握温度、固体表面积、浓度等影响化学反应速率的因素,(4)中注意构成原电池后对反应速率的影响,试题培养了学生的分析、归纳能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.某无色溶液中只可能溶有K+、NH4+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子.为分析其组成,现进行如下实验:
①取l0mL该溶液于试管中滴加足量的Ba(N03)2溶液,加稀硝酸酸化后过滤得到0.03mol
白色沉淀甲.
②取上述反应后的滤液,加人AgN03溶液未见沉淀产生.
③另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断正确的是( )
①取l0mL该溶液于试管中滴加足量的Ba(N03)2溶液,加稀硝酸酸化后过滤得到0.03mol
白色沉淀甲.
②取上述反应后的滤液,加人AgN03溶液未见沉淀产生.
③另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断正确的是( )
| A. | 肯定有Na+、Al3+、Mg2+、SO42- | B. | 肯定有Na+、Mg2+、Al3+、Cl- | ||
| C. | 肯定没有Mg2+、HCO3-、MnO4-、Cl- | D. | 肯定没有K+、NH4+、Cl- |
9.几种单核微粒具有相同的核电荷数,则这几种微粒( )
| A. | 一定互为同位素 | B. | 一定是同种原子 | ||
| C. | 一定属于同种元素 | D. | 质量数一定相等 |
10.下列有关化学用语表示正确的是( )
| A. | 丁烷的球棍模型 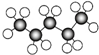 | B. | 乙烯的比例模型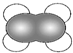 | ||
| C. | 乙醛的结构简式CH3COH | D. | 键线式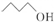 表示的有机物名称为1-戊醇 表示的有机物名称为1-戊醇 |
11.下列实验不能作为判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量的NaOH溶液,判断镁与铝的金属性强弱 | |
| C. | 往硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 根据HF和HCl的水溶液的酸性强弱判断氟与氯的非金属性的强弱 |
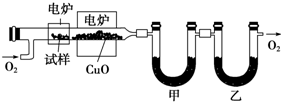
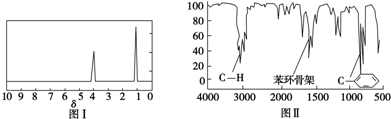
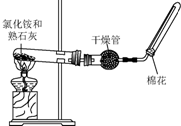 A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).