题目内容
A、B、C、D、E、F六种元素的原子序数依次递增.已知:
①F的原子序数为29,其余的均为短周期主族元素;②E原子价电子(外围电子)排布msnmpn-1;③D原子最外层电子数为偶数;④A、C原子p轨道的电子数分别为2和4.请回答下列问题:
(1)下列叙述正确的是 ;
A.金属键的强弱:D>E
B.基态原子第一电离能:D>E
C.五种元素中,电负性最大与最小的两种金属元素形成的晶体化学式为EB,属于离子晶体
D.晶格能:NaCl<DCl2
(2)F 的核外电子排布式是 ;与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素有 (填元素符号).
(3)A与C形成的非极性分子中,σ键与π键的键数之比为 ;该分子与过量强碱反应生成的酸根离子的空间构型为 ;
(4)已知原子数和价电子数相同的分子或离子为等电子体,互为等电子体的微粒结构相同.B3- 中心原子的杂化轨道类型为 .
①F的原子序数为29,其余的均为短周期主族元素;②E原子价电子(外围电子)排布msnmpn-1;③D原子最外层电子数为偶数;④A、C原子p轨道的电子数分别为2和4.请回答下列问题:
(1)下列叙述正确的是
A.金属键的强弱:D>E
B.基态原子第一电离能:D>E
C.五种元素中,电负性最大与最小的两种金属元素形成的晶体化学式为EB,属于离子晶体
D.晶格能:NaCl<DCl2
(2)F 的核外电子排布式是
(3)A与C形成的非极性分子中,σ键与π键的键数之比为
(4)已知原子数和价电子数相同的分子或离子为等电子体,互为等电子体的微粒结构相同.B3- 中心原子的杂化轨道类型为
考点:原子核外电子排布,元素电离能、电负性的含义及应用,共价键的形成及共价键的主要类型,“等电子原理”的应用
专题:原子组成与结构专题,化学键与晶体结构
分析:A、B、C、D、E、F六种元素的原子序数依次递增.除F元素外,其余的均为短周期主族元素.
①F的原子序数为29,则F为铜元素;
④A、C原子p轨道的电子数分别为2和4,则A核外电子排布式为1s22s22p2,则A为碳元素;C核外电子排布式为1s22s22p4,则C为氧元素.B元素原子序数介于碳元素与氧元素之间,则B为氮元素;
②E原子价电子(外围电子)排布为msnmpn-1,s能级容纳2个电子,则E外围电子排布为ms2mp1,原子序数大于氧元素,则E为铝元素.
③D原子最外层电子数为偶数,D原子序数介于氧元素与铝元素之间,则D为镁元素.
①F的原子序数为29,则F为铜元素;
④A、C原子p轨道的电子数分别为2和4,则A核外电子排布式为1s22s22p2,则A为碳元素;C核外电子排布式为1s22s22p4,则C为氧元素.B元素原子序数介于碳元素与氧元素之间,则B为氮元素;
②E原子价电子(外围电子)排布为msnmpn-1,s能级容纳2个电子,则E外围电子排布为ms2mp1,原子序数大于氧元素,则E为铝元素.
③D原子最外层电子数为偶数,D原子序数介于氧元素与铝元素之间,则D为镁元素.
解答:
解:A、B、C、D、E、F六种元素的原子序数依次递增.除F元素外,其余的均为短周期主族元素.
①F的原子序数为29,则F为铜元素;
④A、C原子p轨道的电子数分别为2和4,则A核外电子排布式为1s22s22p2,则A为碳元素;C核外电子排布式为1s22s22p4,则C为氧元素.B元素原子序数介于碳元素与氧元素之间,则B为氮元素;
②E原子价电子(外围电子)排布为msnmpn-1,s能级容纳2个电子,则E外围电子排布为ms2mp1,原子序数大于氧元素,则E为铝元素.
③D原子最外层电子数为偶数,D原子序数介于氧元素与铝元素之间,则D为镁元素.
(1)A.D为Mg,E为Al,铝离子半径小于镁离子半径,金属键的强弱:D<E,故A错误
B.同周期自左而右基态原子第一电离能增大,基态原子第一电离能:D>E,故B正确;
C.五种元素中,电负性最大是氧元素,电负性最小的是镁元素,两种金属元素形成的晶体化学式为MgO,属于离子晶体,故C正确;
D.晶格能的大小:电荷越高,晶格能越大;离子半径越小,晶格能越大;镁离子半径小于钠离子半径,而镁离子所带电荷大于钠离子所带电荷,故晶格能:NaCl<MgCl2,故D正确;
故答案为:BCD;
(2)F为同元素,核外电子数位29,核外电子排布式是1s22s22p63s23p63d104s1;与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素,价电子排布3d54s1;
核外电子排布式是1s22s22p63s23p63d54s1,为Cr元素;
(3)A为碳元素,C为氧元素,形成的非极性分子O=C=O中,碳氧双键中,含有1个σ键和1个π键,σ键与π键的键数之比1:1;该分子与过量强碱反应生成的酸根离子,为CO32-,碳的最外层价电子4个,因为碳酸根是负2价,4+2=6做为碳酸根碳元素的价电子,氧价电子2个,3个氧原子是6个价电子,碳酸根中碳的价电子6减去氧的价电子总数=0.由此的出中心原子碳的价电子全部成键,无孤对电子,这样空间构型只能是平面三角形;
故答案为:1:1;平面三角形;
(4)N3- 与CO2互为等电子体,O=C=O中含有2个C-O键,形成2条杂化轨道,采用sp杂化;
故答案为:sp.
①F的原子序数为29,则F为铜元素;
④A、C原子p轨道的电子数分别为2和4,则A核外电子排布式为1s22s22p2,则A为碳元素;C核外电子排布式为1s22s22p4,则C为氧元素.B元素原子序数介于碳元素与氧元素之间,则B为氮元素;
②E原子价电子(外围电子)排布为msnmpn-1,s能级容纳2个电子,则E外围电子排布为ms2mp1,原子序数大于氧元素,则E为铝元素.
③D原子最外层电子数为偶数,D原子序数介于氧元素与铝元素之间,则D为镁元素.
(1)A.D为Mg,E为Al,铝离子半径小于镁离子半径,金属键的强弱:D<E,故A错误
B.同周期自左而右基态原子第一电离能增大,基态原子第一电离能:D>E,故B正确;
C.五种元素中,电负性最大是氧元素,电负性最小的是镁元素,两种金属元素形成的晶体化学式为MgO,属于离子晶体,故C正确;
D.晶格能的大小:电荷越高,晶格能越大;离子半径越小,晶格能越大;镁离子半径小于钠离子半径,而镁离子所带电荷大于钠离子所带电荷,故晶格能:NaCl<MgCl2,故D正确;
故答案为:BCD;
(2)F为同元素,核外电子数位29,核外电子排布式是1s22s22p63s23p63d104s1;与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素,价电子排布3d54s1;
核外电子排布式是1s22s22p63s23p63d54s1,为Cr元素;
(3)A为碳元素,C为氧元素,形成的非极性分子O=C=O中,碳氧双键中,含有1个σ键和1个π键,σ键与π键的键数之比1:1;该分子与过量强碱反应生成的酸根离子,为CO32-,碳的最外层价电子4个,因为碳酸根是负2价,4+2=6做为碳酸根碳元素的价电子,氧价电子2个,3个氧原子是6个价电子,碳酸根中碳的价电子6减去氧的价电子总数=0.由此的出中心原子碳的价电子全部成键,无孤对电子,这样空间构型只能是平面三角形;
故答案为:1:1;平面三角形;
(4)N3- 与CO2互为等电子体,O=C=O中含有2个C-O键,形成2条杂化轨道,采用sp杂化;
故答案为:sp.
点评:本题考查物质结构与性质,设计核外电子排布、杂化轨道,晶格能,难度不大,掌握基础知识是解题的关键.

练习册系列答案
相关题目
以等质量的铂棒和铜棒作电极,电解硫酸铜溶液,通电一段时间后,其中一极增加质量为ag,此时两极的质量差可能为( )
| A、ag | ||
| B、2ag | ||
C、
| ||
| D、无法判断 |
在密闭容器中充入CO2、CO、H2、CH4的混合气体共m g,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加m g;则CO2:CO:H2:CH4的体积比为( )
| A、3:1:1:1 |
| B、2:2:2:1 |
| C、1:2:2:1 |
| D、缺少条件,无法计算 |
升高温度,下列数据不一定增大的是( )
| A、电离平衡常数Ka |
| B、水解平衡常数Kb |
| C、化学平衡常数K |
| D、水的离子积常数Kw |
下列关于实验室制乙烯的说法中,错误的是( )
| A、反应温度必须控制在170℃ |
| B、反应物是乙醇和过量的3mol/L硫酸的混合液 |
| C、温度计应插入反应溶液液面以下 |
| D、反应容器中应加入少许瓷片 |
在0.1mol/L的CH3COOH溶液中,要促进醋酸电离,且c(H+)增大,应采取的措施是( )
| A、升温 |
| B、加水 |
| C、加入NaOH溶液 |
| D、加入0.1mol/L HCl |
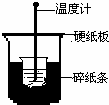 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: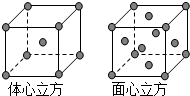 利用有关知识回答下列问题:
利用有关知识回答下列问题: