题目内容
7.有A、B、C、D、E五种前四周期元素,其中A、C、B属于同一周期,且原子序数依次增大;A原子的s电子总数等于p电子总数的2倍;B原子最外层中有两个不成对的电子;D能与B形成的化合物DB2中,D与B的质量比为1:1;E原子的M能层上有4个未成对电子.请完成下列问题:(1)A、B、C三种元素第一电离能由大到小的顺序为C<O<N(用元素符号表示).
(2)DB2分子的空间构型为V型;DB3分子中D原子的杂化类型为sp2.
(3)C的氢化物晶体中,含有的作用力方式有共价键、范德华力、氢键.
(4)A、C可形成一种熔点比金刚石还高的化合物,已知该化合物中各原子最外层都满足8电子稳定结构,且只含σ 键,该化合物的化学式为C3N4.
(5)E是日常生活中的常见金属.
①E基态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2.
②E晶体中原子的堆积方式是体心立方堆积,晶胞中E原子的配位数为8;实验测得E晶体的密度为ρg/cm3,设 E的相对原子质量为M,则晶胞边长为$\root{3}{\frac{2M}{{N}_{A}ρ}}$cm.
分析 A、B、C、D、E五种前四周期元素,A原子的s电子总数等于p电子总数的2倍,则A的核外电子排布为1s22s22p2,故A为碳元素;A、B、C属于同一周期,即位于第二周期,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,故B为O元素;A、C、B属于同一周期,且原子序数依次增大,所以C为N元素,D能与B形成的化合物DB2中,D与B的质量比为1:1,则D为硫元素,E原子的M能层上有4个未成对电子,且原子序数大于硫,则E为第四周期元素,核外电子排布式为1s22s22p63s23p64s2,所以E为铁元素,据此答题.
解答 解:A、B、C、D、E五种前四周期元素,A原子的s电子总数等于p电子总数的2倍,则A的核外电子排布为1s22s22p2,故A为碳元素;A、B、C属于同一周期,即位于第二周期,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,故B为O元素;A、C、B属于同一周期,且原子序数依次增大,所以C为N元素,D能与B形成的化合物DB2中,D与B的质量比为1:1,则D为硫元素,E原子的M能层上有4个未成对电子,且原子序数大于硫,则E为第四周期元素,核外电子排布式为1s22s22p63s23p64s2,所以E为铁元素,
(1)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,能量较低第一电离能高于同周期相邻元素,故C、N、O三种元素的第一电离能由小到大的顺序为:N>O>C,
故答案为:N>O>C;
(2)SO2分子中,硫原子的价层电子对数为$\frac{6}{2}$=3,有一对孤电子对,所以的空间构型为V型,SO3分子中,硫原子的价层电子对数为$\frac{6}{2}$=3,S原子的杂化类型为 sp2,
故答案为:V型; sp2;
(3)C的氢化物为NH3,晶体中含有的作用力方式有共价键、范德华力、氢键,
故答案为:共价键、范德华力、氢键;
(4)A、C可形成一种熔点比金刚石还高的化合物,应为原子晶体,该化合物中各原子最外层都满足8电子稳定结构,且只含σ 键,即单键,所以该化合物的化学式为C3N4,
故答案为:C3N4;
(5)E为铁元素,①铁是26号元素,铁的基态原子的电子排布式为1s22s2 2p6 3s23p63d64s2 或[Ar]3d64s2,
故答案为:1s22s2 2p6 3s23p63d64s2 或[Ar]3d64s2;
②E晶体中原子的堆积方式是体心立方堆积,即铁原子分布在立方体的八个顶点和体心,以体心铁原子为例,与之距离最近的铁离子分布在8个顶点,所以晶胞中铁原子的配位数为8,晶胞含有的铁原子数为$\frac{1}{8}×8+1$=2,根据$ρ=\frac{m}{V}$可知,晶胞边长为$\root{3}{\frac{\frac{2M}{{N}_{A}}}{ρ}}$cm=$\root{3}{\frac{2M}{{N}_{A}ρ}}$cm,
故答案为:8;$\root{3}{\frac{2M}{{N}_{A}ρ}}$cm.
点评 本题是对物质结构的考查,涉及核外电子排布、电子式表示共价化合物形成、价层电子对数理论、杂化发生判断、化学键、晶胞结构等,推断元素是解题关键,注意理解掌握同周期第一电离能异常原因.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案| A. |  | B. | CH3-CH2-CH2-CH2OH | ||
| C. |  | D. |  |
| A. | H2的摩尔质量是2 g | B. | 1 mol H2O的质量是18 g/mol | ||
| C. | 氧气的摩尔质量是32 g/mol | D. | 2 g H2含1 mol H |
| A. | 将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体 | |
| B. | 钠与乙醇反应比与水反应要剧烈得多 | |
| C. | 除去苯中的苯酚可采用加入足量的NaOH溶液后分液的方法 | |
| D. | 除去硫酸铝溶液中混有的硫酸镁,可加入足量烧碱,过滤,向滤液中加入适量硫酸酸化 |
| A. | $\frac{a+b}{4}$ | B. | 4(3a+b) | C. | 4(a+b) | D. | $\frac{3a+b}{4}$ |
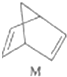 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$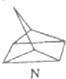 △H═88.6kJ•mol-1
△H═88.6kJ•mol-1