题目内容
12.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:(1)有机物M经过太阳光光照可转化成N,转化过程如下:
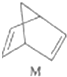 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$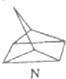 △H═88.6kJ•mol-1
△H═88.6kJ•mol-1则M、N相比,较稳定的是M.
(2)已知CH3OH(l)的燃烧热为726.5kJ•mol-1,CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-a kJ•mol-1,则a<726.5(填“>”、“<”或“=”).
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1 .
(4)火箭和导弹表面的薄层是耐高温物质.将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1176kJ•mol-1,则反应过程中,每转移1mol电子放出的热量为98kJ.
(5)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+489.0kJ•mol-1111.Com]
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
C(石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s)△H=-1641.0kJ•mol-1.
分析 (1)M转化为N是吸热反应,所以N的能量高,不稳定;
(2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a<238.6;
(3)有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,注物质聚集状态和对应反应焓变写出热化学方程式;
(4)所给反应中转移12个电子,故每转移1mol电子放出的热量为1 176kJ÷12=98kJ;
(5)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+489.0kJ•mol-1
②CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1111]
③C(石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
则关键盖斯定律可知(③×3-①-②×3)×2即得.
解答 解:(1)有机物M经过太阳光光照可转化成N,:△H=+88.6kJ•mol-1,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,说明M稳定;
故答案为:M;
(2)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量小于燃烧热;
故答案为:<;
(3)有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1 ;
故答案为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1 ;
(4)4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1176kJ•mol-1,转移12mol电子放热1176KJ,则反应过程中,每转移1mol电子放热98kJ,
故答案为:98kJ;
(5)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+489.0kJ•mol-1
②CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1111]
③C(石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
则关键盖斯定律可知(③×3-①-②×3)×2即得到4Fe(s)+3O2(g)=2Fe2O3(s)的△H=-1641.0kJ•mol-1,故答案为:-1641.0kJ•mol-1.
点评 本题考查了化学反应能量变化,燃烧热概念分析判断,氧化还原反应电子转移的计算应用,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、SiO32-、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入石蕊显蓝色的溶液:Cu2+、Al3+、NO3-、SO42- | |
| D. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等. |
(2)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故.亚硝酸钠和氯化钠的部分性质如表:
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |

| A. | 反应结束时溶液的pH=7 | |
| B. | 反应后溶液中存在的粒子只有Na+和Cl- | |
| C. | 该反应的实质是H+和OH-结合生成水 | |
| D. | 反应前后所有元素的化合价均无变化 |

 中的配位键
中的配位键