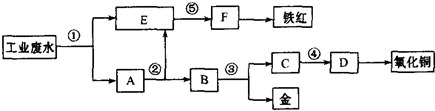
题目内容
有A、B、C、D、E五种可溶性物质,它们所含的阴、阳离子互不相同,分别是以下两组离子中的各一种.
(1)某同学通过分析,认为无需检验就可确定其中两种物质的组成,分别标记为A、B,试写出这两种物质的化学式: 、 .
(2)在C的水溶液中加入Cu片,Cu不溶解,再加适量稀H2SO4,Cu会逐渐溶解.则C中一定含有 离子.
(3)当D与B的溶液混合时,产生红褐色沉淀和无色无味气体;当D与A的溶液混合时,产生棕灰色沉淀,向该沉淀中滴入过量稀HNO3,发现最后仍有白色沉淀残留.则X可能为 离子.
(4)你认为能否通过上述已检验出的物质来确定E的组成?若能,简述实验方案;若不能,简述理由. .
| 阳离子 | Na+ Al3+ Mg2+ Ba2+ Fe3+ |
| 阴离子 | Cl- OH- NO3- CO32- X |
(2)在C的水溶液中加入Cu片,Cu不溶解,再加适量稀H2SO4,Cu会逐渐溶解.则C中一定含有
(3)当D与B的溶液混合时,产生红褐色沉淀和无色无味气体;当D与A的溶液混合时,产生棕灰色沉淀,向该沉淀中滴入过量稀HNO3,发现最后仍有白色沉淀残留.则X可能为
(4)你认为能否通过上述已检验出的物质来确定E的组成?若能,简述实验方案;若不能,简述理由.
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:(1)根据碳酸根离子和钡离子与其它离子能够形成的可溶性物质分析;
(2)铜在酸性条件下和硝酸根离子发生氧化还原反应;
(3)根据当含X离子的D与B的溶液混 合时,产生红褐色沉淀和无色无味气体,说明发生了双水解,推断出B为碳酸钠,则A为氢氧化钡,再根据当D与A的溶液混合时产生两种沉淀,向该沉淀中滴入足量的稀HNO3,沉淀部分溶解,最后留有白色沉淀,推断出D为硫酸铁;
(4)利用氢氧化钡溶液或碳酸钠溶液进行鉴别.
(2)铜在酸性条件下和硝酸根离子发生氧化还原反应;
(3)根据当含X离子的D与B的溶液混 合时,产生红褐色沉淀和无色无味气体,说明发生了双水解,推断出B为碳酸钠,则A为氢氧化钡,再根据当D与A的溶液混合时产生两种沉淀,向该沉淀中滴入足量的稀HNO3,沉淀部分溶解,最后留有白色沉淀,推断出D为硫酸铁;
(4)利用氢氧化钡溶液或碳酸钠溶液进行鉴别.
解答:
解:(1)因阳离子中Al3+、Mg2+、Ba2+、Fe3+均不能与CO32-共存,所以CO32-只能与Na+结合成Na2CO3存在,又因Al3+、Mg2+、Fe3+均不能与OH-共存,所以OH-只能与Ba2+结合成Ba(OH)2存在,
故答案为:Ba(OH)2;Na2CO3;
(2)根据加入铜,不溶解,加入硫酸溶解,说明存在硝酸根离子,反应的方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:NO3-;
(3)D与B的溶液混合时,产生红褐色沉淀和无色无味气体,很明显是Fe3+与CO32-发生双水解的现象,不难得出B为Na2CO3,A为Ba(OH)2,D中有Fe3+,又因D与A反应产生的白色沉淀不溶于稀HNO3所以D为Fe2(SO4)3,故X为SO42-,
故答案为:SO42-;
(4)用上述已经确定的氢氧化钡溶液或者碳酸钠溶液,可以检验出E中的阳离子,检验方法为:向E的水溶液中加入过量A[Ba(OH)2],若最后有沉淀,则E为MgCl2,否则为AlCl3或向E的水溶液中加入适量B(Na2CO3),若只产生沉淀,则E为MgCl2,否则为AlCl3,
答:向E的水溶液中加入过量A[Ba(OH)2],若最后有沉淀,则E为MgCl2,否则为AlCl3或向E的水溶液中加入适量B(Na2CO3),若只产生沉淀,则E为MgCl2,否则为AlCl3.
故答案为:Ba(OH)2;Na2CO3;
(2)根据加入铜,不溶解,加入硫酸溶解,说明存在硝酸根离子,反应的方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:NO3-;
(3)D与B的溶液混合时,产生红褐色沉淀和无色无味气体,很明显是Fe3+与CO32-发生双水解的现象,不难得出B为Na2CO3,A为Ba(OH)2,D中有Fe3+,又因D与A反应产生的白色沉淀不溶于稀HNO3所以D为Fe2(SO4)3,故X为SO42-,
故答案为:SO42-;
(4)用上述已经确定的氢氧化钡溶液或者碳酸钠溶液,可以检验出E中的阳离子,检验方法为:向E的水溶液中加入过量A[Ba(OH)2],若最后有沉淀,则E为MgCl2,否则为AlCl3或向E的水溶液中加入适量B(Na2CO3),若只产生沉淀,则E为MgCl2,否则为AlCl3,
答:向E的水溶液中加入过量A[Ba(OH)2],若最后有沉淀,则E为MgCl2,否则为AlCl3或向E的水溶液中加入适量B(Na2CO3),若只产生沉淀,则E为MgCl2,否则为AlCl3.
点评:本题考查了常见离子的检验方法,题目难度较大,考查学生的综合运用知识的能力,运用假设法和排除法进行筛选,即可判断出几种离子的组合.

练习册系列答案
相关题目
质量相等的N2和H2的物质的量之比为( )
| A、1:14 | B、14:1 |
| C、1:7 | D、7:1 |


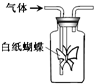 如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )
如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )