题目内容
不同量的H2O(g)和CO(g)分别通入体积为1L的恒容密闭容器中进行反应,CO(g)+H2O (g)?CO2(g)+H2(g),得到以下三组数据:
据此回答下列问题:
(1)由以上数据,实验1中达到平衡时以v(CO2)表示的反应速率为 mol/(L?min ),该反应在650℃时的平衡常数数值为 ,该反应为 (填”吸“或”放“)热反应;
(2)若实验3要达到与实验2 相同的平衡状态(即各组分的体积分数相同),则a、b、c的值分别为 、 、 .
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | 900 | a | b | c | d | t |
(1)由以上数据,实验1中达到平衡时以v(CO2)表示的反应速率为
(2)若实验3要达到与实验2 相同的平衡状态(即各组分的体积分数相同),则a、b、c的值分别为
考点:化学平衡的计算,等效平衡
专题:
分析:(1)利用化学反应速率的计算公式计算;平衡常数=
,利用转化率与消耗量和起始量的关系计算并判断反应热;
(2)从等效平衡的角度分析,转化为起始量和原起始量相同得到相同的平衡状态;
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
(2)从等效平衡的角度分析,转化为起始量和原起始量相同得到相同的平衡状态;
解答:
解:(1)图表中分析可知生成二氧化碳物质的量为0.8mol,反应速率v(CO2)=
=0.16mol/(L?min),依据化学平衡三段式列式计算平衡浓度,650°C CO(g)+H2O (g)?CO2(g)+H2(g),
起始量(mol/L) 2 1 0 0
变化量(mol/L) 0.8 0.8 0.8 0.8
平衡量(mol/L) 1.2 0.2 0.8 0.8
平衡常数K=
=2.67
900°C,CO(g)+H2O (g)?CO2(g)+H2(g),
起始量(mol/L) 1 0.5 0 0
变化量(mol/L) 0.2 0.2 0.2 0.2
平衡量(mol/L)0.8 0.3 0.2 0.2
平衡常数K=
=0.167
随温度升高平衡常数减小,平衡逆向进行,正反应为放热反应;
故答案为:0.16;2.67,放;
(2)若实验3要达到与实验2等效的平衡状态,则所加入物质的物质的量之比等于初始原料的配比数,或转化为起始量和原来起始量相同,
900°C,CO(g)+H2O (g)?CO2(g)+H2(g),
起始量(mol/L) 1 0.5 0 0
变化量(mol/L) 0.2 0.2 0.2 0.2
平衡量(mol/L)0.8 0.3 0.2 0.2
900°C,CO(g)+H2O (g)?CO2(g)+H2(g),
起始量(mol/L) b a c d
转化量(mol/L) c c 0 0
d d 0 0
符合关系 b+c=1 a+c=0.5
b+d=1 a+d=0.5
符合关系b=2a,c=d,
a=0.5 b=1,c=0,d=0
故答案为:0.5,1,0;
| 0.8mol/L |
| 5min |
起始量(mol/L) 2 1 0 0
变化量(mol/L) 0.8 0.8 0.8 0.8
平衡量(mol/L) 1.2 0.2 0.8 0.8
平衡常数K=
| 0.8×0.8 |
| 1.2×0.2 |
900°C,CO(g)+H2O (g)?CO2(g)+H2(g),
起始量(mol/L) 1 0.5 0 0
变化量(mol/L) 0.2 0.2 0.2 0.2
平衡量(mol/L)0.8 0.3 0.2 0.2
平衡常数K=
| 0.2×0.2 |
| 0.8×0.3 |
随温度升高平衡常数减小,平衡逆向进行,正反应为放热反应;
故答案为:0.16;2.67,放;
(2)若实验3要达到与实验2等效的平衡状态,则所加入物质的物质的量之比等于初始原料的配比数,或转化为起始量和原来起始量相同,
900°C,CO(g)+H2O (g)?CO2(g)+H2(g),
起始量(mol/L) 1 0.5 0 0
变化量(mol/L) 0.2 0.2 0.2 0.2
平衡量(mol/L)0.8 0.3 0.2 0.2
900°C,CO(g)+H2O (g)?CO2(g)+H2(g),
起始量(mol/L) b a c d
转化量(mol/L) c c 0 0
d d 0 0
符合关系 b+c=1 a+c=0.5
b+d=1 a+d=0.5
符合关系b=2a,c=d,
a=0.5 b=1,c=0,d=0
故答案为:0.5,1,0;
点评:本题考查化学平衡和化学反应速率等知识,做题时注意把握影响平衡移动的因素以及平衡常数的有关计算,此为化学平衡常考查问题.

练习册系列答案
相关题目
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是C( )
| A、pH=4的醋酸中:c(H+)=4.0mol?L-1 |
| B、pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
| C、饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D、饱和小苏打溶液中:c(Na+)=c(HCO3-) |
用石墨电极电解AlCl3溶液时,下列曲线合理的是( )
A、 |
B、 |
C、 |
D、 |
将2.7gAl与100mL2mol?L-1H2SO4溶液充分反应后,再慢慢滴入25mL4mol?L-1KOH溶液,其结果是( )
| A、得到澄清透明的溶液 |
| B、所得溶液的pH为7 |
| C、取少量所得溶液,加KHCO3,无明显现象发生 |
| D、另取少量所得溶液,加入几滴KOH溶液,有白色沉淀 |



 (苯胺,易被氧化)
(苯胺,易被氧化) 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: 的流程图:
的流程图: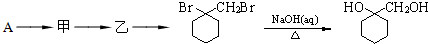 完成甲→乙的化学反应方程式:
完成甲→乙的化学反应方程式:
 为原料
为原料 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:

 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH