题目内容
化学能与电能的转化
(1)将干净的铁片浸在熔化的液体锌里可制得热镀锌铁板,这种铁板具有很强的耐腐蚀能力.镀锌铁板的镀锌层一旦被破坏后,锌将作为原电池的 极,发生 反应(填“氧化”或“还原”)而损耗,铁受到保护.
(2)已知铅蓄电池的电池反应是 2PbSO4+2H2O
PbO2+Pb+2H2SO4,则该铅蓄电池在充电时阳极的电极反应式: ;
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 .
(4)用惰性电极电解CuSO4溶液的总反应离子方程式为: ;
若要将电解后溶液恢复原状,则需要加 .
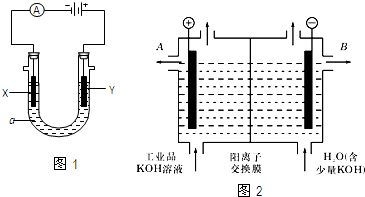
(5)电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是
①A膜是 离子交换膜
②通电后,a电极的电极反应式为
③通电后,b电极上产生的现象为

(1)将干净的铁片浸在熔化的液体锌里可制得热镀锌铁板,这种铁板具有很强的耐腐蚀能力.镀锌铁板的镀锌层一旦被破坏后,锌将作为原电池的
(2)已知铅蓄电池的电池反应是 2PbSO4+2H2O
| 充电 |
| 放电 |
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为
(4)用惰性电极电解CuSO4溶液的总反应离子方程式为:
若要将电解后溶液恢复原状,则需要加
(5)电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是
①A膜是
②通电后,a电极的电极反应式为
③通电后,b电极上产生的现象为

考点:电解原理,原电池和电解池的工作原理
专题:电化学专题
分析:(1)在原电池中,活泼金属做负极,发生失电子的氧化反应;
(2)在充电时是电解池的工作原理,阳极上发生失电子的氧化反应;
(3)根据原电池原理,正极发生的是化合价降低得电子的反应;
(4)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电;依据“析出什么加入什么”的原则加入物质;
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;
②根据阳极是氯离子放电来书写电极反应式;
③阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大.
(2)在充电时是电解池的工作原理,阳极上发生失电子的氧化反应;
(3)根据原电池原理,正极发生的是化合价降低得电子的反应;
(4)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电;依据“析出什么加入什么”的原则加入物质;
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;
②根据阳极是氯离子放电来书写电极反应式;
③阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大.
解答:
解:(1)镀锌铁板的镀锌层一旦被破坏后,较活泼金属锌将作为原电池的负极,发生失电子的氧化反应,故答案为:负;氧化;
(2)充电时,阳极PbSO4发生氧化反应,PbSO4+2H2O-2e-=PbO2+4H++SO42-,故答案为:PbSO4+2H2O-2e-=PbO2+4H++SO42-;
(3)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:4H++O2+4e-═2H2O,故答案为:4H++O2+4e-═2H2O;
(4)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,所以电池反应式为2Cu2++2H2O
2Cu+O2↑+4H+;
阴极上析出铜,阳极上析出氧气,根据“析出什么加入什么”的原则知,加入CuO可以使溶液恢复原状,也可以加入适量的CuCO3使溶液恢复原状,
故答案为:2Cu2++2H2O
2Cu+O2↑+4H+;CuO或CuCO3.
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜A和阳极相连,阳极是阴离子放电,所以隔膜A是阴离子交换膜,
故答案为:阴;
②通电后,a电极为阳极,阳极是氯离子放电,生成氯气,其电极反应为:2Cl--2e-═Cl2↑,故答案为:2Cl--2e-=Cl2↑;
③通电后,b电极为阴极,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大,和钙离子,镁离子形成沉淀,故答案为:产生无色气体,溶液中出现少量白色沉淀.
(2)充电时,阳极PbSO4发生氧化反应,PbSO4+2H2O-2e-=PbO2+4H++SO42-,故答案为:PbSO4+2H2O-2e-=PbO2+4H++SO42-;
(3)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:4H++O2+4e-═2H2O,故答案为:4H++O2+4e-═2H2O;
(4)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,所以电池反应式为2Cu2++2H2O
| ||
阴极上析出铜,阳极上析出氧气,根据“析出什么加入什么”的原则知,加入CuO可以使溶液恢复原状,也可以加入适量的CuCO3使溶液恢复原状,
故答案为:2Cu2++2H2O
| ||
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜A和阳极相连,阳极是阴离子放电,所以隔膜A是阴离子交换膜,
故答案为:阴;
②通电后,a电极为阳极,阳极是氯离子放电,生成氯气,其电极反应为:2Cl--2e-═Cl2↑,故答案为:2Cl--2e-=Cl2↑;
③通电后,b电极为阴极,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大,和钙离子,镁离子形成沉淀,故答案为:产生无色气体,溶液中出现少量白色沉淀.
点评:本题考查了原电池和电解池原理的应用,主要考查了电极反应的书写、电极判断、题干信息的分析应用等,题目难度不大.

练习册系列答案
相关题目
从宏观方面看物质是由元素组成的,从微观方面看物质是由粒子构成的,下列有关说法不正确的是( )
| A、元素原子的多样性是由构成原子的质子和中子数目引起的 |
| B、元素的化学性质主要取决于元素原子的最外层电子数 |
| C、只由一种分子构成的物质一定是纯净物 |
| D、质子数等于电子数的微粒,可能是一种分子和一种离子 |
下列事实能证明HNO2是弱电解质的是( )
| A、用HNO2溶液做导电性试验灯光较暗 |
| B、HNO2是共价化合物 |
| C、常温下,0.1 mol/L HNO2溶液的pH为2.2 |
| D、HNO2溶液不与NaCl反应 |
一定温度下,将2molX和1molY通入体积为1L的密闭容器中,发生反应2X(g)+Y(g)?2Z(g)△H<0,其中Z的浓度随时间变化的数据如下表所示:
下列说法不正确的是( )
| 时间 | 0min | 2min | 4min | 6min | 8min | 10min |
| Z的浓度mol/L | 0 | 0.8 | 1.2 | 1.4 | 1.4 | 1.4 |
| A、用Y来表示0-4min的平均反应速率为0.15mol/(L?min) |
| B、该温度下反应的化学平衡常数为18.15 |
| C、向平衡体系中再加入2molX和1mol Y,达到新的平衡时X的体积分数增大 |
| D、对平衡体系降低温度,化学反应后速率减慢,但Y的转化率增大 |
 电解原理在工业生产中有广泛的应用.
电解原理在工业生产中有广泛的应用.
 +H2O
+H2O