题目内容
将2.7gAl与100mL2mol?L-1H2SO4溶液充分反应后,再慢慢滴入25mL4mol?L-1KOH溶液,其结果是( )
| A、得到澄清透明的溶液 |
| B、所得溶液的pH为7 |
| C、取少量所得溶液,加KHCO3,无明显现象发生 |
| D、另取少量所得溶液,加入几滴KOH溶液,有白色沉淀 |
考点:化学方程式的有关计算
专题:
分析:n(Al)=
=0.1mol,n(H2SO4)=0.1L×2mol/L=0.2mol,由2Al+3H2SO4=Al2(SO4)3+3H2↑可知,参加反应硫酸为0.1mol×
=0.15mol,故剩余硫酸为0.2mol-0.15mol=0.05mol,再慢慢滴入25mL 4mol/LKOH溶液,n(KOH)=0.025L×4mol/L=0.1mol,由H2SO4+2KOH=K2SO4+2H2O,可知剩余硫酸与KOH恰好反应,最终溶液为Al2(SO4)3、K2SO4混合溶液,据此解答.
| 2.7g |
| 27g/mol |
| 3 |
| 2 |
解答:
解:n(Al)=
=0.1mol,n(H2SO4)=0.1L×2mol/L=0.2mol,由2Al+3H2SO4=Al2(SO4)3+3H2↑可知,参加反应硫酸为0.1mol×
=0.15mol,故剩余硫酸为0.2mol-0.15mol=0.05mol,再慢慢滴入25mL 4mol/LKOH溶液,n(KOH)=0.025L×4mol/L=0.1mol,由H2SO4+2KOH=K2SO4+2H2O,可知剩余硫酸与KOH恰好反应,最终溶液为Al2(SO4)3、K2SO4混合溶液,
A.反应后溶液中溶质为Al2(SO4)3、K2SO4,没有氢氧化铝生成,为澄清透明的溶液,故A正确;
B.反应后溶液中溶质为Al2(SO4)3、K2SO4,硫酸铝水解显酸性,pH<7,故B错误;
C.硫酸铝与KHCO3反应生成氢氧化铝沉淀、二氧化碳气体,现象明显,故C错误;
D.另取少量所得溶液,加入几滴KOH溶液,生成氢氧化铝白色沉淀,故D正确;
故选AD.
| 2.7g |
| 27g/mol |
| 3 |
| 2 |
A.反应后溶液中溶质为Al2(SO4)3、K2SO4,没有氢氧化铝生成,为澄清透明的溶液,故A正确;
B.反应后溶液中溶质为Al2(SO4)3、K2SO4,硫酸铝水解显酸性,pH<7,故B错误;
C.硫酸铝与KHCO3反应生成氢氧化铝沉淀、二氧化碳气体,现象明显,故C错误;
D.另取少量所得溶液,加入几滴KOH溶液,生成氢氧化铝白色沉淀,故D正确;
故选AD.
点评:本题考查Al元素单质及其化合物性质、化学方程式有关计算,涉及过量计算问题,侧重对学生分析计算能力的考查,题目难度中等.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
在一定温度下,将气体X和Y各1.6mol充入10L恒容密闭容器中,发生如下反应:X(g)+Y(g)?2Z△H
在反应过程中,X的物质的量与时间的关系如下表所示:下列说法不正确的是( )
在反应过程中,X的物质的量与时间的关系如下表所示:下列说法不正确的是( )
| t/min | 0 | 2 | 4 | 6 | 8 | … | 16 | 18 |
| n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | … | … | 1.000 | 1.000 |
| A、4~6min时间段内Z的平均反应速率为2.5×10-3mol/(L?min) | ||
| B、此温度下该反应的平衡常数K=1.44 | ||
C、达平衡后,升高温度,
| ||
| D、若保持其他条件不变,再充入1.6mol Z,达新平衡后Z的体积分数不变 |
关于中和热测定实验的下列说法不正确的是( )


| A、烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 |
| B、使用环形玻璃棒既可以搅拌又避免损坏温度计 |
| C、向盛装酸的烧杯中加碱时要小心缓慢 |
| D、测定酸后的温度计要用蒸馏水清洗干燥后再测碱的温度 |
有4种有机物:① ,②
,② ,③
,③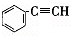 ,④CH3-CH=CH-CN,其中可用于合成
,④CH3-CH=CH-CN,其中可用于合成 结构简式为的高分子材料的正确组合为( )
结构简式为的高分子材料的正确组合为( )
 ,②
,② ,③
,③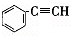 ,④CH3-CH=CH-CN,其中可用于合成
,④CH3-CH=CH-CN,其中可用于合成 结构简式为的高分子材料的正确组合为( )
结构简式为的高分子材料的正确组合为( )| A、①③④ | B、①②③ |
| C、①②④ | D、②③④ |

 某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL 冰醋酸混合,分别进行制取乙酸乙酯的研究.
某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL 冰醋酸混合,分别进行制取乙酸乙酯的研究.