题目内容
 某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.
某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.(1)经测定甲厂的废水明显呈酸性,故乙厂废水中所含的三种离子应该是
(2)如果要回收废水中的金属银,可以在废水中加入过量的一种常见金属,反应后的溶液中只含一种金属阳离子,过滤所得固体的成分是
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出生成红褐色沉淀的离子方程式是:
考点:常见阳离子的检验,几组未知物的检验
专题:离子反应专题
分析:甲厂废水呈酸性,则乙厂废水呈碱性,乙厂含大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,故Ag+、Fe3+存在甲厂,根据离子共存,Cl-、OH-能和Ag+、Fe3+反应,故Cl-、OH-存在乙厂,据溶液电中性可知甲厂废水存NO3-,乙厂废水存在Na+,由此可知:甲厂含有Ag+、Fe3+、NO3-,乙厂含有KNa+、Cl-、OH-,根据两厂中含有的离子组成及性质解答该题.
解答:
解:(1)甲厂废水呈酸性,则乙厂废水呈碱性,乙厂含大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,故Ag+、Fe3+存在甲厂,根据离子共存,
Cl-、OH-能和Ag+、Fe3+反应,故Cl-、OH-存在乙厂,据溶液电中性可知甲厂废水存NO3-,乙厂废水存在K+,由此可知:甲厂含有Ag+、Fe3+、NO3-,乙厂含有K+、Cl-、OH-,故答案为:Na+、Cl-、OH-;
(2)含有的金属离子有K+、Ag+、Fe3+,加入单质Fe,可置换出Ag,过滤得到铁和银的混合物,再加入足量的稀硫酸把铁溶解,过滤洗涤即可得到银;
故答案为:Fe、Ag;向固体中加入足量稀硫酸,充分反应后过滤,洗涤即得到银.
(3)将甲厂和乙厂的废水按适当的比例混合,生成沉淀的离子有Ag+、Fe3+、Cl-、OH-,故红褐色沉淀为氢氧化铁,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓;
故答案为:Fe3++3OH-=Fe(OH)3↓.
Cl-、OH-能和Ag+、Fe3+反应,故Cl-、OH-存在乙厂,据溶液电中性可知甲厂废水存NO3-,乙厂废水存在K+,由此可知:甲厂含有Ag+、Fe3+、NO3-,乙厂含有K+、Cl-、OH-,故答案为:Na+、Cl-、OH-;
(2)含有的金属离子有K+、Ag+、Fe3+,加入单质Fe,可置换出Ag,过滤得到铁和银的混合物,再加入足量的稀硫酸把铁溶解,过滤洗涤即可得到银;
故答案为:Fe、Ag;向固体中加入足量稀硫酸,充分反应后过滤,洗涤即得到银.
(3)将甲厂和乙厂的废水按适当的比例混合,生成沉淀的离子有Ag+、Fe3+、Cl-、OH-,故红褐色沉淀为氢氧化铁,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓;
故答案为:Fe3++3OH-=Fe(OH)3↓.
点评:本题考查离子共存问题,题目难度不大,注意判断甲乙厂废水成分的角度以及离子的性质.

练习册系列答案
相关题目
下列反应的离子方程式错误的是( )
| A、向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、氢氧化钡溶液与硫酸氢钠溶液1:1混合Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| D、向溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
对于溶液中某些离子的检验及结论一定正确的是( )
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+ |
碰撞理论是一种较直观的反应速率理论,下列有关碰撞理论叙述正确的是( )
| A、反应物分子必须碰撞才有可能发生反应 |
| B、发生有效碰撞的分子具有最高的能量 |
| C、有效碰撞是活化分子在一定方向上的碰撞 |
| D、活化分子的平均能量称之活化能 |
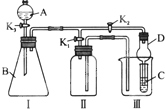 某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题:
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题: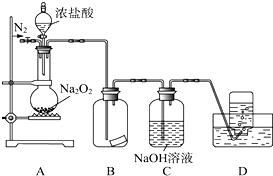 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下:
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下: Na2O2+
Na2O2+