题目内容
某溶液中可能存在Al3+、Cl-、Mg2+、Na+、Br-、CO32-、SO32-等七种离子中的几种.现取该溶液进行实验,得到如下现象:
①向该溶液中滴加足量氯水后有无色无味气体产生,再加入CCl4振荡,下层液体呈红棕色;②取上层无色溶液,加入足量Ba(NO3)2溶液,无沉淀产生;
③向所得溶液中继续滴加AgNO3溶液,有不溶于HNO3的白色沉淀产生.
据此可以推断,该溶液中肯定存在的离子是 ,可能存在的离子是 .
①向该溶液中滴加足量氯水后有无色无味气体产生,再加入CCl4振荡,下层液体呈红棕色;②取上层无色溶液,加入足量Ba(NO3)2溶液,无沉淀产生;
③向所得溶液中继续滴加AgNO3溶液,有不溶于HNO3的白色沉淀产生.
据此可以推断,该溶液中肯定存在的离子是
考点:常见阳离子的检验,常见阴离子的检验
专题:
分析:①向溶液中滴加足量氯水后,有无色无味气泡冒出,说明溶液中含离子CO32-;再加入CCl4振荡,下层液体呈红棕色,说明溶液中含有Br-;
②取上层无色溶液,加入足量Ba(NO3)2溶液,无沉淀生成,说明不含SO32-;
③向所得溶液中加入AgNO3溶液,有不溶于HNO3的白色沉淀产生,即氯化银生成,又因为开始加了氯水引入了氯离子,所以不能判断原溶液是否含氯离子.
②取上层无色溶液,加入足量Ba(NO3)2溶液,无沉淀生成,说明不含SO32-;
③向所得溶液中加入AgNO3溶液,有不溶于HNO3的白色沉淀产生,即氯化银生成,又因为开始加了氯水引入了氯离子,所以不能判断原溶液是否含氯离子.
解答:
解:①向溶液中滴加足量氯水后,有无色无味气泡冒出,说明溶液中含离子CO32-;再加入CCl4振荡,下层液体呈红棕色,说明溶液中含有Br-;
②取上层无色溶液,加入足量Ba(NO3)2溶液,无沉淀生成,说明不含SO32-;
③向所得溶液中加入AgNO3溶液,有不溶于HNO3的白色沉淀产生,即氯化银生成,又因为开始加了氯水引入了氯离子,所以不能判断原溶液是否含氯离子;
溶液中含有CO32-,则一定不含有Al3+、Mg2+,因与CO32-反应生成沉淀,
根据溶液呈电中性原则,溶液中一定含有Na+,
所以溶液中一定含有的离子为CO32-、Br-、Na+,可能存在的离子是 Cl-;
故答案为:CO32-、Na+、Br-; Cl-.
②取上层无色溶液,加入足量Ba(NO3)2溶液,无沉淀生成,说明不含SO32-;
③向所得溶液中加入AgNO3溶液,有不溶于HNO3的白色沉淀产生,即氯化银生成,又因为开始加了氯水引入了氯离子,所以不能判断原溶液是否含氯离子;
溶液中含有CO32-,则一定不含有Al3+、Mg2+,因与CO32-反应生成沉淀,
根据溶液呈电中性原则,溶液中一定含有Na+,
所以溶液中一定含有的离子为CO32-、Br-、Na+,可能存在的离子是 Cl-;
故答案为:CO32-、Na+、Br-; Cl-.
点评:本题考查离子的检验及离子共存问题,题目难度中等,注意把握反应的实验现象,结合离子的性质进行判断.

练习册系列答案
相关题目
下图为向25ml0.1mol/LNaOH溶液中逐滴0.2mol/L醋酸溶液,曲线如下图所示,在AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
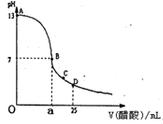

| A、c(OH-)一定大于c(CH3COO-) |
| B、c(OH-)一定小于c(CH3COO-) |
| C、c(OH-)一定等于c(CH3COO-) |
| D、上述三种情况都可能 |
已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KClO3,且
的值与温度高低有关.当n(KOH)=a mol时,下列有关说法错误的是( )
| c(Cl-) |
| c(ClO-) |
A、参加反应的氯气的物质的量等于
| ||||||||
B、若某温度下,反应后
| ||||||||
C、改变温度,产物中KC1O3的最大理论产量为
| ||||||||
D、改变温度,反应中转移电子的物质的量ne的范围:
|