题目内容
常温下,某一元弱酸的电离平衡常数为:Ka=10-6,对于0.01mol?L-1的该酸,下列说法不正确是( )
| A、该弱酸溶液的pH=4 |
| B、加入NaOH溶液后,弱酸的电离平衡向右移动,但Ka不变 |
| C、加入等体积的0.01mol?L-1NaOH溶液后,所得的溶液的pH<7 |
| D、该弱酸的钠盐溶液一定会发生水解,常温下,其水解平衡常数Kh=10-8 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A、弱酸的电离程度很小,[HA]可以近似于起始浓度,据Ka=
求算氢离子浓度;
B、据影响弱电解质的电离平衡移动的因素和Ka只受温度影响分析;
C、等物质的量的弱酸和强碱中和后生成强碱弱酸盐,水解显碱性;
D、结合Ka和KW可得Kh.
| [H+]?[A-] |
| [HA] |
B、据影响弱电解质的电离平衡移动的因素和Ka只受温度影响分析;
C、等物质的量的弱酸和强碱中和后生成强碱弱酸盐,水解显碱性;
D、结合Ka和KW可得Kh.
解答:
解:A、Ka=
,有Ka?[HA]=[H+]?[A-]=10-8,c(H+)=10-4,pH=4,故A正确;
B、在弱酸溶液中加入NaOH,中和了氢离子,平衡正向移动,Ka只受温度影响,温度不变时Ka不变,故B正确;
C、等物质的量的弱酸和强碱中和后生成强碱弱酸盐,水解显碱性,在弱酸溶液中加入等体积的0.01mol?L-1NaOH溶液后,所得的溶液的pH>7,故C错误;
D、NaA水解的离子方程式为:A-+H2O?HA-OH-,Kh=
=
=
=10-8,故D正确;
故选C.
| [H+]?[A-] |
| [HA] |
B、在弱酸溶液中加入NaOH,中和了氢离子,平衡正向移动,Ka只受温度影响,温度不变时Ka不变,故B正确;
C、等物质的量的弱酸和强碱中和后生成强碱弱酸盐,水解显碱性,在弱酸溶液中加入等体积的0.01mol?L-1NaOH溶液后,所得的溶液的pH>7,故C错误;
D、NaA水解的离子方程式为:A-+H2O?HA-OH-,Kh=
| [OH-]?[HA] |
| [A-] |
| KW |
| Ka |
| 10-14 |
| 10-6 |
故选C.
点评:本题考查了弱电解质的电离平衡及电离平衡常数的相关计算,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
水是生命之源,下列关于水的说法正确的是( )
| A、海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 |
| B、某温度下,pH=6的蒸馏水显酸性 |
| C、氯气有毒,因而自来水的杀菌消毒一定不能使用氯气 |
| D、明矾可用于水的净化与杀菌消毒 |
CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2而得到.现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液.电解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色.对阳极区溶液呈蓝色的正确解释是( )
| A、2 I--2e-=I2 碘遇淀粉变蓝 |
| B、Cu-2e-=Cu2+ Cu2+ 显蓝色 |
| C、2Cu+4I--4e-=2CuI↓+I2 碘遇淀粉变蓝 |
| D、4OH--4e-=2H2O+O2 O2将I-氧化为I2,碘遇淀粉变蓝 |
下列实验装置或实验操作使用正确的是( )
A、 |
B、 |
C、 |
D、 |

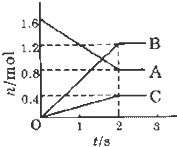 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为