题目内容
9.下列实验方案中,能达到相应实验目的是( )| A | B | C | D | |
| 方案 | 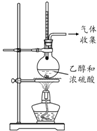 |  | 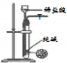 | 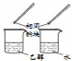 |
| 目的 | 利用乙醇的消去反应制取乙烯 | 蒸发NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量纯净的CO2气体 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙醇和浓硫酸混合制取乙烯需要加热170℃,温度计测量混合溶液温度;
B.氯化铵受热易分解生成氨气和氯化氢;
C.纯碱是粉末状固体,不能用简易启普发生器;
D.钠和乙醇、水都能反应生成氢气,根据反应剧烈程度确定羟基中H原子的活泼性.
解答 解:A.乙醇和浓硫酸混合制取乙烯需要加热170℃,温度计测量混合溶液温,所以温度计水银球应该位于混合溶液中,故A错误;
B.氯化铵受热易分解生成氨气和氯化氢,所以得不到氯化铵晶体,故B错误;
C.纯碱是粉末状固体,不能用简易启普发生器,应该用稀盐酸和石灰石制取二氧化碳,故C错误;
D.钠和乙醇、水都能反应生成氢气,与钠反应的剧烈程度取决于羟基中H原子的活泼性,所以能实现实验目的,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、氢原子活泼性比较、仪器的使用等知识点,明确实验原理、物质性质差异性、仪器的用途等是解本题关键,侧重考查学生观察分析判断能力,注意A中温度计的位置,为易错点.

练习册系列答案
相关题目
1.下表是元素周期表的一部分,针对表中的①-⑧种元素,填写下列空白;
(1)上述元素中,形成化合物种类最多的是C(填元素符号);
(2)元素①的非金属性比元素⑥强,可以用来证明该结论的事实是:碳酸的酸性比硅酸的酸性强;
(3)元素②的气态氢化物与⑧的单质发生置换反应的方程式为2NH3+Cl2=N2+6HCl;
(4)元素③和④形成的化合物中可以做供氧剂、漂白剂的是Na2O2(填化学式);
(5)元素③、⑤和⑦形成的化合物常用于工业污水的处理,其主要作用为铝离子水解生成胶体具有吸附性,可净化水.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)元素①的非金属性比元素⑥强,可以用来证明该结论的事实是:碳酸的酸性比硅酸的酸性强;
(3)元素②的气态氢化物与⑧的单质发生置换反应的方程式为2NH3+Cl2=N2+6HCl;
(4)元素③和④形成的化合物中可以做供氧剂、漂白剂的是Na2O2(填化学式);
(5)元素③、⑤和⑦形成的化合物常用于工业污水的处理,其主要作用为铝离子水解生成胶体具有吸附性,可净化水.
20.下列叙述错误的是( )
| A. | 盛装在敞口玻璃容器中的碘化钾溶液,在空气中久置后,可能会显黄色 | |
| B. | 次氯酸不稳定,见光即分解,可与强碱发生中和反应,则证明次氯酸为弱酸 | |
| C. | 铜粉在氯气中燃烧生成棕色的烟 | |
| D. | 氯水久置后溶液的酸性增强 |
17.1-丙醇的蒸气和空气混合,通过灼热的铜网生成一种新的化合物.下列物质中,和该化合物互为同分异构体的是( )
| A. | CH3CH2CHO | B. | CH3CH2COOH | C. | CH3COCH3 | D. | CH3CH2OCH3 |
4.液氧是航天活动一种重要氧化剂,常与液氢或煤油等配合使用,以下说法错误的是( )
| A. | 工业通过分馏液态空气制备液氧 | |
| B. | 液氧不可燃,铁路旅客可以随身携带 | |
| C. | 液氧与液氢搭配做火箭推进剂的优点之一是清洁环保 | |
| D. | 沥青若长时间浸入液氧可能会发生爆炸 |
14. 某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.
某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.
(1)CO的检测.
①粉红色的PdCl2溶液可以检验空气中少量的CO.若空气中含CO,则溶液中会产生黑色的Pd沉淀,每生成5.3gPd沉淀,反应转移电子数为0.1NA.
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图1所示,这种传感器利用了燃料电池原理.则该电池的负极反应式为CO+H2O-2e-=CO2+2H+.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如表:
①上述反应T1℃时的平衡常数为K=$\frac{9}{16}$.
②根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,反应原理为NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O,△<0在氨气足量的情况下,不同$\frac{c(N{O}_{2})}{c(NO)}$、不同温度对脱氨率的影响如图2所示.请回答温度对脱氨率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小;300℃之前,反应未平衡,反应向右进行,脱氮率增大,给出合理的解释300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小.
(4)硫酸厂尾气中的SO2可催化氧化生成SO3,再合成硫酸.在某温度时,向10L的密闭容器中加入4.0molSO2和10.0molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是BC(填序号)
A.在其他条件不变时,减少容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍.
 某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.
某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.(1)CO的检测.
①粉红色的PdCl2溶液可以检验空气中少量的CO.若空气中含CO,则溶液中会产生黑色的Pd沉淀,每生成5.3gPd沉淀,反应转移电子数为0.1NA.
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图1所示,这种传感器利用了燃料电池原理.则该电池的负极反应式为CO+H2O-2e-=CO2+2H+.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如表:
 | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,反应原理为NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O,△<0在氨气足量的情况下,不同$\frac{c(N{O}_{2})}{c(NO)}$、不同温度对脱氨率的影响如图2所示.请回答温度对脱氨率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小;300℃之前,反应未平衡,反应向右进行,脱氮率增大,给出合理的解释300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小.
(4)硫酸厂尾气中的SO2可催化氧化生成SO3,再合成硫酸.在某温度时,向10L的密闭容器中加入4.0molSO2和10.0molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是BC(填序号)
A.在其他条件不变时,减少容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍.
1.有关下列图象的说法不正确的是( )
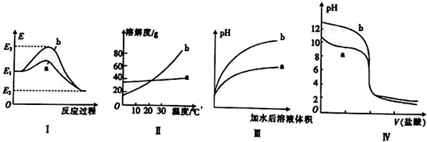

| A. | 图Ⅰ表法某放热反应过程中的能量变化,则曲线a可表示加入催化剂的反应 | |
| B. | 图Ⅱ表示两种盐的溶解度曲线,在较高温度下制得浓溶液再冷却结晶,过滤、洗涤、干燥可得纯净的固体a | |
| C. | 图Ⅲ表示相同pH的盐酸和醋酸分别用水稀释,则曲线a为醋酸 | |
| D. | 图Ⅳ表示相同物质的量浓度的NaOH溶液和氨水分别用盐酸滴定的曲线,则曲线a表示氨水 |
19.下列有关物质的性质或应用均正确的是( )
| A. | 二氧化硅为酸性氧化物,可用于制做计算机芯片 | |
| B. | 铜的金属活泼性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 | |
| D. | 浓硫酸具有脱水性,可用于干燥NH3、SO2等 |
 ) ⑤乙醇(C2H5OH)与甲醚(CH3-O-CH3)⑥
) ⑤乙醇(C2H5OH)与甲醚(CH3-O-CH3)⑥ 和
和