题目内容
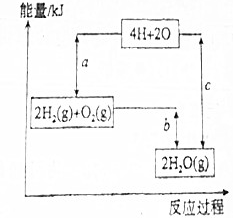
20.下列化学反应中,反应物总能量高于生成物总能量的是( )| A. | 铝片和稀盐酸反应 | B. | 氢氧化钡晶体和氯化铵反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 甲烷在氧气中燃烧 |
分析 反应物总能量高于生成物总能量的是放热反应,根据常见的吸热反应和放热反应分析,常见的放热反应有:所有的物质燃烧、金属与酸或水反应、中和反应、铝热反应、绝大多数化合反应、食物腐败、炸药爆炸等;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),Ba(OH)2•8H2O和NH4Cl反应.
解答 解:A.铝片和稀盐酸反应是金属与酸的反应,是放热反应,故A正确;
B.氢氧化钡晶体和氯化铵反应是吸热反应,故B错误;
C.灼热的碳与CO2反应生成CO,是吸热反应,故C错误;
D.甲烷在氧气中燃烧是放热反应,故D正确;
故选AD.
点评 本题考查吸热反应和放热反应,难度不大,明确常见的吸热反应和放热反应类型是解题的关键,注意基础知识的积累.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
10.化学与生活密切相关,下列说法中不正确的是( )
| A. | Al2O3 熔点高,可用于制作耐高温仪器 | |
| B. | 水果、蔬菜等是碱性食物 | |
| C. | 高纯度的硅单质可用于制作光导纤维 | |
| D. | 绿色化学的核心是从源头上杜绝污染的产生 |
11.有关该物质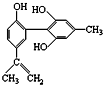 的说法正确的是( )
的说法正确的是( )
 的说法正确的是( )
的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 该分子中的所有碳原子不可能共平面 | |
| C. | 滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| D. | 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol |
8.同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验.经充分反应后,瓶内溶质的物质的量浓度为,假设溶质不扩散( )
| A. | ①=② | B. | ①<② | C. | ①>② | D. | 不能确定 |
15.下列叙述正确的是( )
| A. | H2O的摩尔质量为18g | |
| B. | 3.01×1023个SO2分子的质量为32g | |
| C. | 标准状况下,1 mol任何物质体积均为22.4L | |
| D. | 将0.1mol NH3溶于1L水,配成溶液中溶质的物质的量浓度为0.1mol/L |
12.欲除去Cl2中的少量HCl气体,可选用( )
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | 饱和食盐水 | D. | 石灰水 |
7.决定化学反应速率的最主要因素是( )
| A. | 反应物浓度 | B. | 反应温度 | ||
| C. | 反应物自身的性质 | D. | 是否使用催化剂 |