题目内容
10.化学与生活密切相关,下列说法中不正确的是( )| A. | Al2O3 熔点高,可用于制作耐高温仪器 | |
| B. | 水果、蔬菜等是碱性食物 | |
| C. | 高纯度的硅单质可用于制作光导纤维 | |
| D. | 绿色化学的核心是从源头上杜绝污染的产生 |
分析 A.制作耐高温仪器的材料,应满足熔点高特点;
B.食物呈酸性或成碱性,是按食物在体内代谢最终产物的性质来分类的;
C.光导纤维主要成分是二氧化硅;
D.从源头上消除工业生产对环境的污染是绿色化学的核心.
解答 解:A.Al2O3 熔点高,耐高温,可用于制作耐高温仪器,故A正确;
B.蔬菜、水果多含钾、钠、钙、镁等盐类,在人体内代谢后生成碱性物质,使体液呈弱碱性,这类食物习惯上称为碱性食物,故B正确;
C.二氧化硅具有良好的光学特性,光导纤维主要成分是二氧化硅,不是硅,故C错误;
D.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染,故D正确;
故选:C.
点评 本题主要考查化学物质与生活得关系、绿色化学的概念、碱式食物与酸性食物的判断、物质的用途,熟悉氧化铝、二氧化硅的性质及相关概念即可解答,注意平时要注意多积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.根据化学反应3NO2+H2O→2HNO3+X,推断X的化学式为( )
| A. | NO | B. | N2 | C. | N2O3 | D. | N2O5 |
5.把Mmol H2和Nmol C2H4混合,在一定条件下使它们一部分发生反应生成Wmol C2H6,将反应后所得的混合气体完全燃烧,消耗氧气的物质的量为( )
| A. | (M+3N)mol | B. | ($\frac{M}{2}$+3N)mol | C. | ($\frac{M}{2}$+3N+$\frac{7}{2}$W)mol | D. | ($\frac{M}{2}$+3N-$\frac{7}{2}$W)mol |
2.下列化学用语正确的是( )
| A. | -OH的电子式: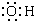 | |
| B. | 硫离子结构示意图: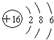 | |
| C. | 氢氧化铜电离方程式:Cu(OH)2═Cu2++2OH- | |
| D. | 乙酸的分子式:C2H4O2 |
20.下列化学反应中,反应物总能量高于生成物总能量的是( )
| A. | 铝片和稀盐酸反应 | B. | 氢氧化钡晶体和氯化铵反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 甲烷在氧气中燃烧 |
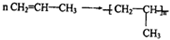 ,该反应的反应类型为加聚反应.
,该反应的反应类型为加聚反应.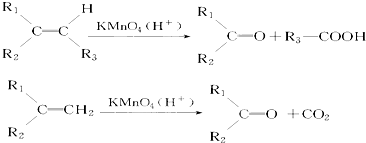
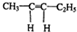 .若该烯烃的一种同分异构体与酸性高锰酸钾溶液反应得到的产物为二氧化碳和丁酮(
.若该烯烃的一种同分异构体与酸性高锰酸钾溶液反应得到的产物为二氧化碳和丁酮(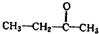 ),则此烯烃的结构简式为
),则此烯烃的结构简式为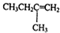 ,名称为2-甲基-1-丁烯;丁酮中官能团的名称为羰基.
,名称为2-甲基-1-丁烯;丁酮中官能团的名称为羰基.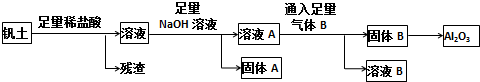
 .
.