题目内容
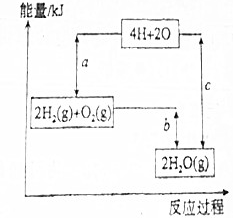
5.(1)已知锌银铅蓄电池以KOH为电解质溶液,放电时的总反应是Zn+Ag2O═ZnO+2Ag,则该电池的负极材料是Zn,放电时负极区的pH减小(填“增大”“减小”或“不变”).(2)已知破坏1mol H-H键、1mol O═O键、1mol H-O键时分别需要吸收436kJ、498kJ、463kJ能量,如图表示的是2mol H2(g)和1mol O2(g)转化为2mol H2O(g)的反应过程中能量变化,则a=1370KJ,b=-482KJ.
分析 (1)电池反应式为:Zn+Ag2O═ZnO+2Ag,根据化合价变化可知Zn被氧化,发生氧化反应,应为原电池的负极,结合电极方程式判断pH的变化;
(2)化学反应中,化学键的断裂需要吸收能量,形成新化学键放出能量,反应热等于反应物键能之和减去生成物的总键能之和.
解答 解:(1)原电池的负极发生氧化反应,化合价升高,锌银铅蓄电池发生的电池总反应为Ag2O+Zn═ZnO+2Ag,反应中Zn的化合价升高被氧化,应为原电池的负极,锌银电池中负极锌失电子,电极反应式:Zn+2OH--2e-=ZnO+H2O,Ag元素化合价降低,被还原,为正极反应,正极氧化银得电子,电极方程式为Ag2O+H2O+2e-=2Ag+2OH-,负极消耗OH-,则pH降低,正极生成OH-,则pH升高,
故答案为:Zn;减小;
(2)反应2H2(g)+O2(g)=2H2O(g)的能量变化如图1所示.已知拆开1molH2、1molO2和1molH-O中的化学键分别需要消耗436KJ、498KJ和463KJ能量,
2molH2和1molO2参加反应断裂化学键吸收的能量为:2×436kJ+498kJ=1370kJ,即a值,
生成2molH2O(g)形成新化学键放出的能量为:4×463kJ=1852kJ,即C值,
反应的焓变△H=2×436KJ/mol+498KJ/mol-2×2×463KJ/mol=-482KJ/mol,即b值,
故答案为:1370KJ;-482KJ.
点评 本题考查了原电池、化学反应焓变的计算,为高频考点,侧重于学生的分析能力的考查,明确原电池原理、掌握反应热量与化学键的关系是解答本题关键,题目难度中等.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
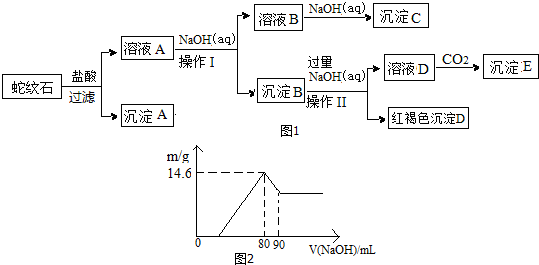
16.经初步检测蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2等组成.分析如图1:
请回答下列问题:
(1)蛇纹石与盐酸充分反应后再过滤即可得溶液A.在过滤中用到的玻璃仪器有烧杯、玻璃棒、漏斗.
(2)沉淀B的组成是Al(OH)3、Fe(OH)3,向溶液A中逐滴加入NaOH溶液,以控制溶液pH在C的范围内可得到符合图1关系的沉淀B.(填写下列正确选项前的字母.有关氢氧化物沉淀的pH见下表,且pH达到7.8时,氢氧化铝开始溶解.)
A.1~3 B.3~5 C.5~7 D.7~8
(3)写出向溶液D中通入过量CO2反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)向溶液A中逐滴加入5mol•mol-1NaOH溶液,经过操作I和操作II得到的沉淀质量与V[NaOH(aq)]有图2所示的数据关系.经分析蛇纹石中Fe2O3与Al2O3的物质的量之比为2:1.

请回答下列问题:
(1)蛇纹石与盐酸充分反应后再过滤即可得溶液A.在过滤中用到的玻璃仪器有烧杯、玻璃棒、漏斗.
(2)沉淀B的组成是Al(OH)3、Fe(OH)3,向溶液A中逐滴加入NaOH溶液,以控制溶液pH在C的范围内可得到符合图1关系的沉淀B.(填写下列正确选项前的字母.有关氢氧化物沉淀的pH见下表,且pH达到7.8时,氢氧化铝开始溶解.)
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.9 | 3.3 | 9.4 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
(3)写出向溶液D中通入过量CO2反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)向溶液A中逐滴加入5mol•mol-1NaOH溶液,经过操作I和操作II得到的沉淀质量与V[NaOH(aq)]有图2所示的数据关系.经分析蛇纹石中Fe2O3与Al2O3的物质的量之比为2:1.
13.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )
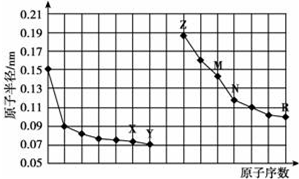

| A. | 简单离子的半径:X<Z<M | |
| B. | 最高价氧化物对应水化物的酸性:R<N | |
| C. | Y、R两种元素的气态氢化物稳定性:Y>R | |
| D. | 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
20.下列化学反应中,反应物总能量高于生成物总能量的是( )
| A. | 铝片和稀盐酸反应 | B. | 氢氧化钡晶体和氯化铵反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 甲烷在氧气中燃烧 |
17.下列对各组物质性质的比较中,正确的是( )
| A. | 沸点:HF<HCl | B. | 熔点:Al>Na | C. | 密度:H2O>MgCl2 | D. | 硬度:C<Si |
12.用锌与稀硫酸反应制H2时,下列能延缓反应速率但又不影响生成氢气总量的是( )
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量CH3COONa固体 | D. | 改用98%的浓硫酸 |
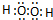 .
.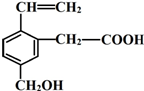 某有机物的结构简式如图,该物质不应有的化学性质是⑥⑦
某有机物的结构简式如图,该物质不应有的化学性质是⑥⑦