题目内容
16.下列化合物既能与稀盐酸反应又能与NaOH溶液反应的是( )①Al
②(NH4)2CO3
③Al2O3
④Ca(HCO3)2
⑤AgNO3
⑥Al(OH)3.
| A. | ①②③④⑤⑥ | B. | ②③④⑥ | C. | ②③④⑤⑥ | D. | ①②③⑥ |
分析 既能与酸又能与碱反应的物质有:铝、两性氧化物、两性氢氧化物、弱酸酸式盐、弱酸的铵盐、氨基酸等,以此来解答.
解答 解:①Al与盐酸、NaOH均反应,为单质,故不选;
②(NH4)2CO3与盐酸、NaOH均反应,为化合物,故选;
③Al2O3 与盐酸、NaOH均反应,为化合物,故选;
④Ca(HCO3)2 与盐酸、NaOH均反应,为化合物,故选;
⑤AgNO3与盐酸反应生成AgCl,与NaOH反应生成AgOH,为化合物,故选;
⑥Al(OH)3与盐酸、NaOH均反应,为化合物,故选;
故选C.
点评 本题考查元素化合物知识,为高考常见题型,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意归纳与酸碱反应的物质,题目难度不大.

练习册系列答案
相关题目
5.下列叙述不正确的是( )
| A. | 糖类、油脂、蛋白质都是高分子化合物 | |
| B. | 淀粉遇碘溶液变蓝 | |
| C. | 正丁烷和异丁烷互为同分异构体 | |
| D. | 天然气的主要成分是甲烷 |
5.下表是25℃时三种弱酸的电离平衡常数:
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因NO2-+H2O?HNO2+OH-.
(2)NaHCO3的电离方程式是NaHCO3=Na++HCO3-.
(3)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为CO32->A->HCO3->NO2-.
(4)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),解释HA和NaA的混合溶液呈碱性的原因A-离子水解程度大于HA电离程度.
(5)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-.
(6)某同学用Na2CO3和NaHCO3溶液进行如图所示实验.
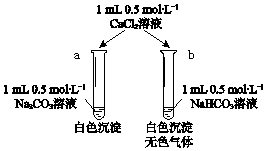
①充分反应后a试管中大量存在的离子是Na+、Cl-.
②用离子方程式表示b试管中发生的反应2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O.
| 化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
| Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
(1)用离子方程式表示NaNO2溶液呈碱性的原因NO2-+H2O?HNO2+OH-.
(2)NaHCO3的电离方程式是NaHCO3=Na++HCO3-.
(3)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为CO32->A->HCO3->NO2-.
(4)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),解释HA和NaA的混合溶液呈碱性的原因A-离子水解程度大于HA电离程度.
(5)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-.
(6)某同学用Na2CO3和NaHCO3溶液进行如图所示实验.

①充分反应后a试管中大量存在的离子是Na+、Cl-.
②用离子方程式表示b试管中发生的反应2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O.
4.下列过程中吸收热量的是( )
| A. | 甲烷的燃烧 | B. | 浓硫酸的稀释 | ||
| C. | NH4Cl与Ba(OH)2•8H2O反应 | D. | 铝热反应 |
11.烷烃 是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( )
是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( )
 是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( )
是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( )| A. | 8种 | B. | 6种 | C. | 2种 | D. | 1种 |
1. 已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
 已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )| A. | 2H(g)→H2(g)△H>0 | B. | 图中E1=932kJ | ||
| C. | 图中E2=926 kJ | D. | 2H2(g)+O2(g)═2H2O(g)△H=-484 kJ•mol-1 |
8.设阿伏加德罗常数为NA,下列说法中正确的是(Mg-24 H-1 O-16)( )
| A. | 18g H2O含有的电子数8NA | |
| B. | 常温常压下,1L0.2mol/L MgCl2溶液中含Cl-数为0.2NA | |
| C. | 常温常压下,22.4L的氧气中含氧原子数为2NA | |
| D. | 2.4g的Mg粉与足量的盐酸反应失去电子数为0.2NA |
10.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 铁上镀锌的保护方法叫牺牲负极的正极保护法 | |
| B. | 相同条件下,轮船在海水中比在淡水中腐蚀慢 | |
| C. | 钢铁在潮湿的空气中会发生吸氧腐蚀,负极反应为Fe-3e-=Fe3+ | |
| D. | 水库里钢闸门与电源负极相连的方法叫做外加电流的阴极保护法 |
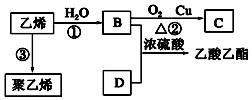 已知乙烯能发生以下转化:
已知乙烯能发生以下转化: ,列举聚乙烯的一种用途制塑料.
,列举聚乙烯的一种用途制塑料.