题目内容
10.(现有下列5种有机物A.苯 B.乙烯 C.乙烷 D.乙醇 E.乙酸.(填代号)①能与H2发生加成反应的有A、B.
②能与Na反应的有D、E.
③能与NaOH溶液反应的有E.
④常温下能与溴水反应的有B.
分析 (1)能与H2发生加成反应的应含有不饱和键或苯环;
(2)能与Na反应的含有羟基、羧基;
(3)含有羧基、酚羟基的有机物能与NaOH溶液反应;
(4)不饱和键与溴水发生加成反应,苯酚与溴水发生取代反应
解答 解:(1)苯可与氢气发生加成反应生成环己烷,乙烯含有碳碳双键,可与氢气发生加成反应生成乙烷,故答案为:A、B;
(2)乙醇含有羟基,乙酸含有羧基,可与钠反应生成氢气,故答案为:D、E;
(3)乙酸含有羧基,具有酸性,可与氢氧化钠发生中和反应,故答案为:E;
(4)乙烯含有碳碳双键,可与溴发生加成反应,故答案为:B.
点评 本题考查有机物的结构与性质,为高频考点,侧重常见有机物性质的考查,把握醇、酸、烃的性质为解答的关键,题目难度不大.

练习册系列答案
相关题目
1.下列各组物质中,化学键类型相同,晶体类型也相同的是( )
| A. | Cl2和 KCl | B. | SiO2 和 CO2 | C. | CH4和 H2O | D. | KCl和 HCl |
18.下列各组物质中属于同系物的是( )
| A. | 金刚石和C60 | B. |  与 与 | ||
| C. |  与 与  | D. | CH3CH3与CH3CH2CH2CH3 |
5.下表是25℃时三种弱酸的电离平衡常数:
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因NO2-+H2O?HNO2+OH-.
(2)NaHCO3的电离方程式是NaHCO3=Na++HCO3-.
(3)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为CO32->A->HCO3->NO2-.
(4)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),解释HA和NaA的混合溶液呈碱性的原因A-离子水解程度大于HA电离程度.
(5)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-.
(6)某同学用Na2CO3和NaHCO3溶液进行如图所示实验.
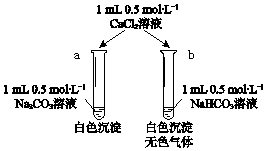
①充分反应后a试管中大量存在的离子是Na+、Cl-.
②用离子方程式表示b试管中发生的反应2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O.
| 化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
| Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
(1)用离子方程式表示NaNO2溶液呈碱性的原因NO2-+H2O?HNO2+OH-.
(2)NaHCO3的电离方程式是NaHCO3=Na++HCO3-.
(3)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为CO32->A->HCO3->NO2-.
(4)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),解释HA和NaA的混合溶液呈碱性的原因A-离子水解程度大于HA电离程度.
(5)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-.
(6)某同学用Na2CO3和NaHCO3溶液进行如图所示实验.

①充分反应后a试管中大量存在的离子是Na+、Cl-.
②用离子方程式表示b试管中发生的反应2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O.
15.下列有机物的命名正确的是( )
| A. | 2-甲基-2,3-二氯戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 2,4,6-三氯己烷 | D. | 3-甲基-3-丁烯 |
4.下列过程中吸收热量的是( )
| A. | 甲烷的燃烧 | B. | 浓硫酸的稀释 | ||
| C. | NH4Cl与Ba(OH)2•8H2O反应 | D. | 铝热反应 |
1.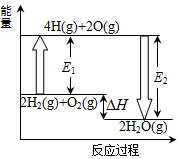 已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
 已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )| A. | 2H(g)→H2(g)△H>0 | B. | 图中E1=932kJ | ||
| C. | 图中E2=926 kJ | D. | 2H2(g)+O2(g)═2H2O(g)△H=-484 kJ•mol-1 |
6.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 2.24 L CH4中含碳原子数目是0.1 NA | |
| B. | 0.1 mol•L-1 NaNO3溶液中含Na+数目是0.1 NA | |
| C. | 1 mol Cl2与足量的铁完全反应时得到的电子数目是2 NA | |
| D. | 标准状况下,22.4 L苯中含分子数目是NA |