题目内容
下列操作不能达到目的是( )
| 选项 | 目的 | 操作 |
| A | 配置100ml1.0mol/CuSO4溶液 | 将25gCuSO4.5H2O溶于100ml蒸馏水是 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 检验溶液中是否存在Fe3+ | 去少量溶液滴加硫氰化钾溶液 |
| D | 除去Na2CO3溶液中的少量NaHCO3 | 去混合物加入适量氢氧化钠溶液 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.水的体积不等于溶液的体积;
B.硝酸钾和氯化钠的溶解度随温度的变化不同,可用重结晶法分离;
C.Fe3+遇硫氰化钾呈血红色;
D.碳酸氢钠能与氢氧化钠反应生成碳酸钠和水.
B.硝酸钾和氯化钠的溶解度随温度的变化不同,可用重结晶法分离;
C.Fe3+遇硫氰化钾呈血红色;
D.碳酸氢钠能与氢氧化钠反应生成碳酸钠和水.
解答:
解:A.水的体积不等于溶液的体积,应加水至溶液的体积等于100mL,故A错误;
B.硝酸钾和氯化钠的溶解度随温度的变化不同,可用重结晶法分离,故B正确;
C.Fe3+遇硫氰化钾呈血红色,可检验,故C正确;
D.碳酸氢钠能与氢氧化钠反应生成碳酸钠和水,可除杂,故D正确.
故选A.
B.硝酸钾和氯化钠的溶解度随温度的变化不同,可用重结晶法分离,故B正确;
C.Fe3+遇硫氰化钾呈血红色,可检验,故C正确;
D.碳酸氢钠能与氢氧化钠反应生成碳酸钠和水,可除杂,故D正确.
故选A.
点评:本题考查化学实验方案的评价,涉及物质的分离、检验和溶液的配制等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握物质的性质的异同以及实验的合理性和可行性的评价,难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
我国的PM2.5大气环境质量标准即将出台.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物.PM2.5粒径小,富含大量的有毒、有害物质且在大气中停留时间长,因而对人体健康和大气环境质量影响更大.下列有关说法不正确的是( )
| A、灰霾主要由PM2.5组成 |
| B、PM2.5颗粒直径小,表面积大,吸附能力强,吸附有毒物会增强它的毒性 |
| C、目前我国空气污染指数(API)指标数值范围只包含二氧化硫(SO2)、二氧化氮(NO2)和可吸入颗粒物(PM10)三个指标 |
| D、PM10为可吸入性颗粒,将其纳入空气污染指数(API),是因为其危害比PM2.5更大 |
短周期元素W、X、Y和Z的原子序数依次增大.其中W的原子半径最小,X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,且Y和Z可以形成化合物ZY2和ZY3.根据以上叙述,下列说法中正确的是( )
| A、以上四种元素的原子半径大小为W<X<Y<Z |
| B、W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
下列说法正确的是( )
| A、浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸 |
| B、若R的含氧酸的酸性强于Q的含氧酸的酸性,则非金属性R强于Q |
| C、碳、钠与O2反应时,由于O2的量不同,可分别生成CO、CO2和Na2O、Na2O2 |
| D、所有的酸酐都是氧化物 |

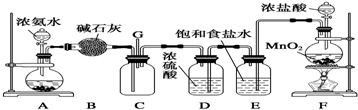
 已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2.为验证该观点是否正确,该同学设计了以下实验.
已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2.为验证该观点是否正确,该同学设计了以下实验.