题目内容
1.短周期元素W、X、Y、Z,原子序数依次增大,原子半径rw<rx<ry,Y的原子最外层只有一个电子,X与Z同主族,且Z的原子序数是X的两倍,下列有关叙述错误的是( )| A. | W一定是氢元素 | |
| B. | 简单离子半径rz>rx>ry | |
| C. | 标准状况下,1mol Z的最高价氧化物的体积约为22.4L | |
| D. | 工业上常用电解熔融Y的氯化物的方法制备Y单质 |
分析 短周期元素W、X、Y、Z,原子序数依次增大,X与Z同主族,且Z的原子序数是X的两倍,可知X为O,Z为S,结合原子半径rw<rx<ry,Y的原子最外层只有一个电子,可知Y为Na,W为H,以此来解答.
解答 解:由上述分析可知,W为H,X为O,Y为Na,Z为S,
A.W若为第二周期元素,其原子半径大于O,则一定为H,故A正确;
B.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径rz>rx>ry,故B正确;
C.标准状况下,Z的最高价氧化物三氧化硫不是气体,不能利用V=nVm计算其体积,故C错误;
D.钠为活泼金属,电解熔融NaCl可冶炼Na,故D正确;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、原子结构、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,选项C为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.化学与生产、生活、社会密切相关,下列有关说法正确的是( )
| A. | 地沟油不宜食用,可分馏提取汽油 | |
| B. | 二氧化硅可用于制造光导纤维 | |
| C. | 为防止富脂食品氧化变质,在包装袋中放入生石灰 | |
| D. | 钠、钾、铁等金属及其化合物能发生焰色反应,可用于制造烟花 |
9.设NA为阿伏伽德罗常数值.下列有关叙述不正确的是( )
| A. | 5.8g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA | |
| B. | 1mol CnH2n-2(n≥2)中所含的共用电子对数为(3n+1)NA | |
| C. | 60克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA |
16.W、X、Y、Z是原子序数依次最大的短周期元素,W的原子半径最小,W、Y同主族,X、Z同主族,且X、Z的原子序数之和是W、Y原子序数之和的2倍,下列说法中不正确的是( )
| A. | 由W和X两种元素形成的化合物可能含有非极性共价键 | |
| B. | 由X、Y、Z三种元素形成的化合物只能为Y2ZX2或Y2ZX4 | |
| C. | 由W、X、Y、Z四种元素形成的化合物水溶液可能呈强酸性 | |
| D. | W、X、Y、Z四种元素两两之间形成二元化合物 |
6.下列指定反应的离子方程式正确的是( )
| A. | 向MgCl2溶液中滴加过量氨水:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| C. | 将Cu粉加入到Fe2(SO4)3溶液中:2Fe3++3Cu═2Fe+3Cu2+ | |
| D. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
13.下列有关钠元素及其化合物的表示正确的是( )
| A. | 钠原子的结构示意图: | |
| B. | 过氧化钠的电子式: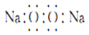 | |
| C. | 小苏打在水中的电离方程式:NaHCO3═Na++HCO3- | |
| D. | 硫化钠的水溶液呈碱性的原因:S2-+2H2O?H2S+2OH- |
10. 某温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下,能够大量共存的一组离子是( )
某温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下,能够大量共存的一组离子是( )
 某温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下,能够大量共存的一组离子是( )
某温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下,能够大量共存的一组离子是( )| A. | a点对应的溶液:Na+、K+、SO42-、Cl- | |
| B. | b点对应的溶液:I-、Mg2+、K+、ClO- | |
| C. | c点对应的溶液:Na+、S2-、F-、NH4+ | |
| D. | a点对应的溶液:CO32-、Cl-、Al3+、SO42- |
2. 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:

A、乙醇 B、Ca(OH)2或Ba(OH)2C、NaOH溶液.
(1)B中盛装的试剂Ca(OH)2或Ba(OH)2(填化学式)
(2)A中加入乙醇的目的是除去H2C2O4,避免对CO2的检验造成干扰.
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4•2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是C2O42-+H2O?HC2O4-+OH-(用离子方程式表示).
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:□MnO4-+□H2C2O4+□6H+=□Mn2++□CO2↑+□H2O
(1)配平上述离子方程式.
(2)滴定时KMnO4溶液应盛装于酸式(填“酸式”或“碱式”)滴定管中.
Ⅱ、探究影响化学反应速率的因素
如表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是探究KMnO4溶液浓度对化学反应速率的影响;
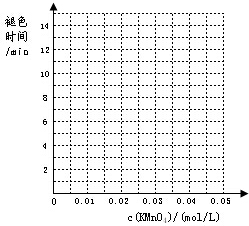
(2)根据表中数据在右边坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图象;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是氯离子可与酸性高锰酸钾发生氧化还原反应.
 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:

A、乙醇 B、Ca(OH)2或Ba(OH)2C、NaOH溶液.
(1)B中盛装的试剂Ca(OH)2或Ba(OH)2(填化学式)
(2)A中加入乙醇的目的是除去H2C2O4,避免对CO2的检验造成干扰.
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4•2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是C2O42-+H2O?HC2O4-+OH-(用离子方程式表示).
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:□MnO4-+□H2C2O4+□6H+=□Mn2++□CO2↑+□H2O
(1)配平上述离子方程式.
(2)滴定时KMnO4溶液应盛装于酸式(填“酸式”或“碱式”)滴定管中.
Ⅱ、探究影响化学反应速率的因素
如表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
| 实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
| 1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6′55″ | (a)探究KMnO4溶液浓度对化学反应速率的影响 |
| 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | ||
| 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | ||
| 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | ||
| 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | ||
| 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
(1)实验目的(a)是探究KMnO4溶液浓度对化学反应速率的影响;
(2)根据表中数据在右边坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图象;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是氯离子可与酸性高锰酸钾发生氧化还原反应.
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示: