题目内容
9.设NA为阿伏伽德罗常数值.下列有关叙述不正确的是( )| A. | 5.8g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA | |
| B. | 1mol CnH2n-2(n≥2)中所含的共用电子对数为(3n+1)NA | |
| C. | 60克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA |
分析 A.质量换算物质的量结合化学式计算;
B.每个碳原子有4个价键,对于烃CxHy分子,除了氢原子之外就是碳与碳之间的共用电子对,由于每两个碳共用这些电子对,因此碳与碳之间的共用电子对数为:$\frac{4x-y}{2}$,利用此公式代入即可求解即可.
C.乙酸、葡萄糖的最简式都是CH2O,60g混合物中含有2mol最简式CH2O,完全燃烧消耗2mol氧气;
D.该反应中Cl元素化合价由+5价、-1价变为0价,有$\frac{1}{6}$的HCl不作还原剂,起酸的作用,氧化剂是K37ClO3、还原剂 H35Cl,该反应转移的电子数为5e-.
解答 解:A.5.8g 2CaSO4•H2O物质的量=$\frac{5.8g}{290g/mol}$=0.02mol,含有的结晶水分子数为0.02NA,故A正确;
B.分子式为CnH2n-2的烃分子中碳碳间共用电子对数为:$\frac{4n-(2n-2)}{2}$=n+1,所含的共用电子对数为(n+1)NA,故B错误;
C.60g乙酸、葡萄糖的混合物中含有2mol最简式CH2O,完全燃烧时消耗2mol氧气,消耗氧气分子数为2NA,故C正确;
D.生成的3mol氯气中含6molCl,其中1mol为 37Cl,5mol为35Cl,生成氯气摩尔质量=$\frac{1×37+5×35}{3}$=70.7g/mol,若有212克氯气生成物质的量=$\frac{212g}{70.7g/mol}$=3mol,生成3mol氯气电子转移5mol,故D正确;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意明确氧化还原反应关系,计算生成氯气的物质的量是解题关键.

练习册系列答案
 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
17.常温常压下,将H2S和O2的混合气体100mL引入反应器中在一定条件下充分反应,恢复到原状况,发现尚留气体25mL.则原混合气体中H2S和O2的体积比为( )
| A. | 1:1 | B. | 4:3 | C. | 3:1 | D. | 3:2 |
4. 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
(1)汽车发动机工作时会引起反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.2 000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=0.0015mol•L-1•min-1,N2的平衡转化率为0.75%,2 000 K时该反应的平衡常数K=2.25×10-4;
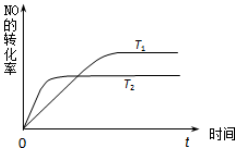
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如图所示.
①反应2NO(g)?N2(g)+O2(g)为放热反应(填“吸热”或“放热”);
②一定温度下,能够说明反应2NO(g)?N2(g)+O2(g)已达到平衡的是c(填序号);
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c.NO、N2、O2的浓度保持不变
d.单位时间内分解4mol NO,同时生成2molN2
③在四个容积和温度均完全相同的密闭容器中分别加入下列物质,相应物质的量(mo1)如表所示.相同条件下达到平衡后,N2的体积分数最大的是D(填容器代号);
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CH4催化还原NO2消除氮氧化物的污染.
已知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2.
 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:(1)汽车发动机工作时会引起反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.2 000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=0.0015mol•L-1•min-1,N2的平衡转化率为0.75%,2 000 K时该反应的平衡常数K=2.25×10-4;
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如图所示.
①反应2NO(g)?N2(g)+O2(g)为放热反应(填“吸热”或“放热”);
②一定温度下,能够说明反应2NO(g)?N2(g)+O2(g)已达到平衡的是c(填序号);
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c.NO、N2、O2的浓度保持不变
d.单位时间内分解4mol NO,同时生成2molN2
③在四个容积和温度均完全相同的密闭容器中分别加入下列物质,相应物质的量(mo1)如表所示.相同条件下达到平衡后,N2的体积分数最大的是D(填容器代号);
| 容器代号 | NO | N2 | O2 |
| A | 2 | 0 | 0 |
| B | 0 | 1 | 1 |
| C | 0.4 | 0.6 | 0.8 |
| D | 1 | 0.5 | 0.4 |
已知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2.
14.下列图示的实验操作,能实现相应实验目的是( )
| A. |  蒸干CuCl2饱和溶液制备无水CuCl2 | |
| B. | 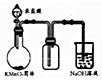 实验室制取并收集少量纯净氯气 | |
| C. | 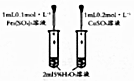 研究催化剂对H2O2分解速率的影响 | |
| D. | 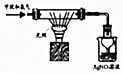 验证甲烷和氧气光照条件下发生取代反应 |
1.短周期元素W、X、Y、Z,原子序数依次增大,原子半径rw<rx<ry,Y的原子最外层只有一个电子,X与Z同主族,且Z的原子序数是X的两倍,下列有关叙述错误的是( )
| A. | W一定是氢元素 | |
| B. | 简单离子半径rz>rx>ry | |
| C. | 标准状况下,1mol Z的最高价氧化物的体积约为22.4L | |
| D. | 工业上常用电解熔融Y的氯化物的方法制备Y单质 |
18.某有机物是一种医药中间体.其结构简式如图所示.下列有关该物质的说法正确的是( )
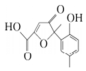

| A. | 该化合物分子中不含手性碳原子 | |
| B. | 该化合物与NaHCO3溶液作用有CO2气体放出 | |
| C. | 1 mol该化合物与足量溴水反应,消耗2 mol Br2 | |
| D. | 在一定条件下,该化合物与HCHO能发生缩聚反应 |
19.下列有关物质的性质与用途具有对应关系的是( )
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| C. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| D. | MgO、Al2O3的熔点都很高,都可用作耐火材料 |